De retour de ses
vacances du Moyen-Orient, un élève de terminale a ramené un échantillon
d’eau de la mer Morte et souhaite vérifier les caractéristiques de
celle-ci.
Il dispose pour cela sur sa paillasse :
- d’une balance de précision affichant une valeur à 0,1g ;
- d’une éprouvette de 100 mL graduée à 1 mL ;
- d’un bécher.
1. Proposer un
protocole expérimental simple lui permettant de déterminer la masse
volumique de l’échantillon d’eau de la mer Morte.
Placer l'éprouvette graduée sur la balance et appuyer sur "tare".
Verser 50 mL d'eau de cette mer dans l'éprouvette et relever
l'indication de la balance. ( 60,5 g)
Diviser la masse lue sur la balance par le volume V = 50 mL
2. Parmi les résultats
obtenus suivants, indiquer celui que l’élève doit conserver :1,211 g cm
-3
;
1,21 g cm-3 ;
1,2 g cm-3
;1 g cm-3.
dr / r = [(dm/m)2
+(dV/V)2]½ =[(0,1 /60,5)2
+(1/50)2]½ ~0,02.
dr =0,02 x1,21 ~
0,024 ; r =1,21
±0,02 g cm-3.
L’élève souhaite maintenant comprendre la raison de la flottaison sur
les eaux de la mer
Morte sans avoir le moindre effort à faire.
Il dispose pour cela des éléments suivants :
- un poids ayant la forme d’un cylindre plein, de densité
supérieure à celle de l’eau et de
volume inconnu ;
- un pied à coulisse permettant la mesure précise de longueurs ;
- un dynamomètre gradué à ,01 N ainsi que sa potence ;
- une éprouvette de 100 mL qui peut contenir le cylindre précédent ;
- une balance affichant une valeur à 0,1 g ;
- de l’eau de la mer Morte.
3. Proposer deux
protocoles différents permettant de mesurer avec précision le volume du
cylindre à l’aide du matériel présent. Soit V
C = 10 mL le
volume du cylindre ainsi
obtenu.
Mesurer le diamètre et la hauteur du cylindre à l'aide du pied à
coulisse.
V =
pD
2
/ 4 H.
Verser 50 mL d'eau dans l'éprouvette graduée puis y introduire le
cylindre. Faire la différence des 2 volumes lus.
Afin de
déterminer la valeur de la poussée d’Archimède qui s’exerçait sur lui
lors des
baignades, l’élève propose de réaliser le montage ci-dessous :
4. Expliquer
comment un tel montage permet de mesurer la valeur de la poussée
d’Archimède s’exerçant sur le cylindre. Préciser notamment le protocole
expérimental
correspondant et représenter sur un schéma les forces exercées sur le
cylindre.
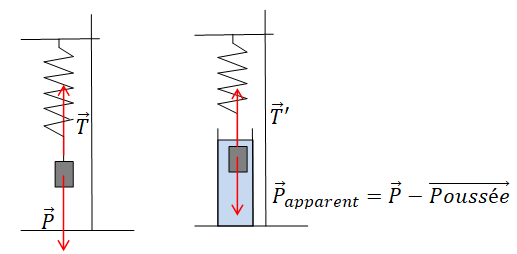
Le dynamomètre affiche alors les valeurs suivantes :
0,67 N si le cylindre est hors de l’eau ; 0,55 N lorsque le
cylindre est totalement immergé dans l’eau.
5. En déduire la
valeur de la norme P
A de la poussée d’Archimède s’exerçant
sur le
cylindre lorsque le cylindre est totalement immergé dans l’eau de la
mer Morte.
P
A = 0,67-0,55 =0,12 N.
Une seconde mesure est réalisée pour le cylindre à moitié
immergé.
6. Parmi les
formules suivantes, indiquer, en justifiant votre réponse, l’expression
correspondant à la poussée d’Archimède exercée sur un corps de volume
immergé V
i
dans un fluide de masse volumique
r. :
rVi g vrai; 2
r g / V
i ; ½V
i2g
/
r ;
r(V
i/2)
2g.
La poussée d'Archimède est égale au poids du volume d'eau déplacé.
Poids = masse x g.
7. Déterminer la valeur
lue sur le dynamomètre pour le cylindre à moitié immergé dans
l’eau de la mer morte.
Poids = 0,67 N ; Poussée = 0,06 N ; Indication lue = 0,67-0,06 = 0,61 N.
8. En modélisant le
corps de l’élève par un cylindre dont vous estimerez un ordre de
grandeur du rayon et de la hauteur, évaluer d’après la photo 1 le
volume immergé de
l’élève dans les eaux de la mer Morte.

Volume moyen du corps humain 73 L.
Volume immergé V
i ~60 L.
9. En déduire la valeur
de la poussée d’Archimède qui s’exerçait sur lui lors de ses
baignades.
1,21 g cm
-3 = 1,21 kg / L ; poussée =1,21 x 60 x 9,8
~7,1 10
2 N.
10.Comparer au
poids estimé de l’élève et commenter.
masse = 75 x1 = 75 kg ; Poids = 73 x 9,8 =7,2 10
2 N.
Le poids et la poussée se compensent.
Chute d'une bille métallique lachée sans
vitesse initiale dans une éprouvette remplie de cette eau.
L'élève décide d'étudier le modèle sur la chute d'une bille dans la
glycérine.
Rayon de la bille : 5,0 mm ; masse volumique de la bille 7560 kg m
-3.
Eprouvette de 500 mL ou l'on peut lire la graduation 242 mm entre 50 mL
et 500 mL.
Période entre deux images 1 /50 s.
La position du centre de gravité de la bille est repérée par son
abscisse z(t) sur un axe vertical descendant. L'action de l'eau est
modélisée par une foce de frottement f = 6
pr
h v.
v : vitesse ; r : rayon de la bille ;
h viscosité dynamique du
fluide.
ra
: masse volumique de la bille ;
rg
: masse volumique du fluide la glycérine.
11. Faire un bilan
des forces extérieures exercées sur la bille.
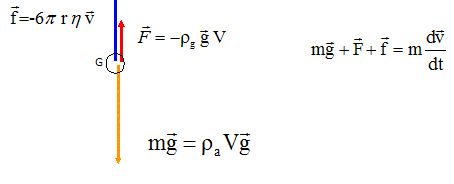
12. Montrer que
l'équation différentielle vérifiée par la vitesse s'écrit : dv/dt + v /
t = (1-
rg/
ra) g.
raVg
-
rgVg -
6prh v. = mdv/dt.
raV = m ; dv/dt +6prh / m =g(1-rgV / m).
rgV / m=rg/ra ; dv/dt +6prh / m = (1-rg/ra) g.
On pose t =m /(6prh ).
13. Donner
l'unité de t et sa signification physique.
t est
la constante de temps exprimée en seconde.
14. Déterminer l'expression de la
vitesse en régime permanent.
dvlim /dt = 0
; vlim = t (1-rg/ra) g.
Le pointage du centre de la bille avec un logiciel de traitement
chronophotographuque permet d'obtenir un fichier texte :
temps(s)
|
abscisse
horizontale x (m)
|
ordonnée
z (m)
|
0,060
|
8,269
E-2
|
-3,556
E-1
|
0,080
|
8,269
E-2 |
-3,451
E-1 |
0,100
|
8,379
E-2 |
-3,330
E-1 |
0,120
|
8,269
E-2 |
-3,192
E-1 |
0,140
|
8,269
E-2 |
-2,889
E-1 |
Un programme
Python permet d'exploiter ce fichier afin de calculer la vitesse de la
bille.
42 vitesse = [(vitesse [i-1] +z[i] )*(t[i]-t[i-1]) for i in range (1 ;
L) ]
43 vitesse = [(z[i] / t[i] for i in range (L-1)]
44
vitesse =
[(z[i]-z[i-1]) / (t[i] -t[i-1] for i in range (1,L)]
45
vitesse =
[(z[i+1]-z[i]) / (t[i+1] -t[i] for i in range (L-1)]
15. Parmi ces 4
lignes de calcul, préciser, en argumentant la réponse , celle(s) qui
permette(nt) de calculer la vitesse.
On calcule la vitesse moyenne entre deux instants très proches en
divisant une distance par une durée. Donc lignes 44 ou 45.
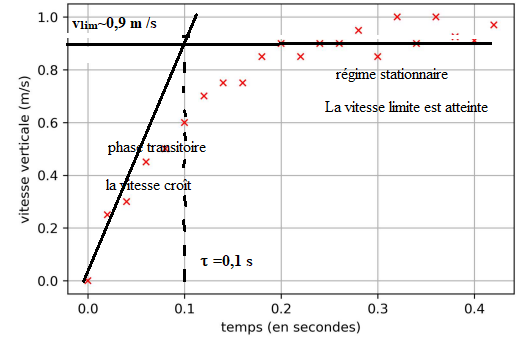
La courbe de la vitesse obtenue par le programme est tracée ci-dessous.
16. Qualifier
chaque phase.
 17.
17. Associer à
chaque phase le schéma A ou B.
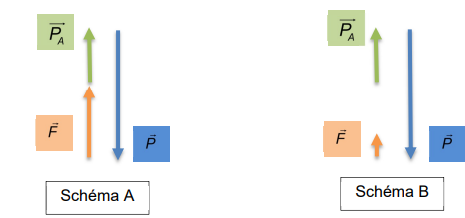
A : les forces se compensent, la vitesse limite est atteinte.
18. Déterminer
graphiquement v
lim et
t.
v
lim ( asymptotoe horizontale) : 0,95 m /s.
Intersection de la tangente à l'origine avec l'asymptote :
t =0,1 s.
19. Déterminer la
masse volumique de la glycérine.
vlim = t
(1-rg/ra) g ; ra=7,56
g /cm3.
1-rg/ra=vlim / ( t
g)=0,9 /(0,1 x9,8)~0,918.
rg/ra=1-0,918 =
0,0816 ; rg
= 0,0,816 x7,56 ~0;62 g / cm3.
20. La masse
volumique de la glycérine donnée dans les tables est 1,26 g / cm
3
à 25°C. Conclure quant à la pertinence de cette méthode.
Ecart relatif : ~ 50%. Cette méthode est peu précise ( imprécision sur
la vitesse limite déterminée graphiquement).
.