L’encre bleue utilisée
dans les stylos-plume contient, entre autres, du bleu d’aniline
qui contribue à sa couleur. C’est cette couleur qui doit disparaître
lors de
l’utilisation d’un effaceur.
Dans un premier temps, l’objectif de l’exercice est l’étude du bleu
d’aniline, la
détermination de sa masse dans une cartouche d’encre, et dans un second
temps, l’étude de la vitesse de disparition de l’encre lorsqu’on
efface.
Pour simplifier, on note, dans la suite de l’exercice, le bleu d’aniline (2 Na
+(aq) ; HBleu
2–(aq)). On suppose que
seuls les ions HBleu
2–(aq) sont responsables de la couleur de l’encre.
Masse molaie bleu d’aniline M = 737,7
g / mol ;
couple oxydant / réducteur associé au bleu d’aniline : HBleu
2–(aq) / H
3Bleu
2–(aq) ;
couple oxydant / réducteur hydrogénosulfate / hydrogénosulfite : HSO
4
–
(aq) / HSO
3
–
(aq) ;
les solutions aqueuses d’ions H
3Bleu
2–(aq), HSO
4
–
(aq) et HSO
3
–
(aq) sont incolores.
1. Le bleu d’aniline.
Pour caractériser la couleur du bleu d’aniline d’une cartouche d’encre, on vide intégralement une cartouche
d’encre dans une fiole jaugée de 200,0 mL et on complète avec de l’eau distillée jusqu’au trait de jauge. On
obtient la solution S
encre dont on réalise le spectre grâce à un spectrophotomètre qui est représenté ci-dessous.
1.1. Justifier la couleur de la solution S
encre.
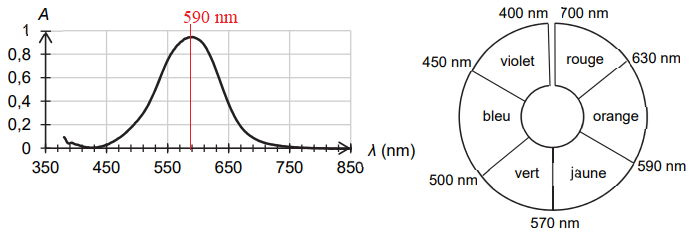
Le maximum d'absorption se situe à 590 nm ( jaune orangé). La solution
possède la couleur complémentaire du jaune orangé soit le bleu violet.
Pour déterminer la masse en bleu d’aniline dans la cartouche d’encre dans la solution S
encre, on réalise une
solution mère S
0 à une concentration en bleu d’aniline de c
0 = 6,78×10
–4 mol·L
–1.
À partir de la solution mère S
0, on réalise plusieurs solutions filles :
1.2. Nommer la verrerie nécessaire pour réaliser la solution fille S
1.
V
0 = 10 mL solution mère prélevé à l'aide d'une pipette jaugée de 10,0 mL.
Fiole jaugée de 100,0 mL.
1.3. Déterminer la valeur de la concentration en quantité de matière de la solution fille S
2.
V0 = 20 mL solution mère. Fiole jaugée de 100,0 mL.
V0 c0 =0,020 x 6,78×10–4 =1,356 10-5 mol.
Concentration : 1,356 10-5 /0,100 ~1,36 10-4 mol / L.
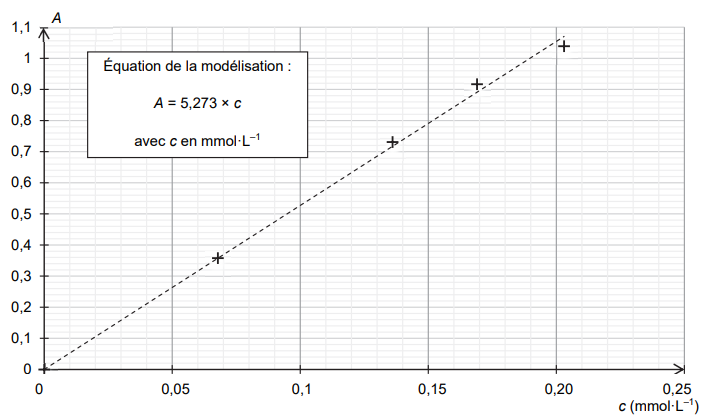
On représente l’absorbance des différentes solutions filles en fonction de la concentration en bleu d’aniline,
mesurée à la longueur d’onde
l = 590 nm retenue pour l’étude.
 1.4.
1.4. À la longueur d’onde retenue pour l’étude, l’absorbance de la solution S
encre est égale à 0,9. Déterminer
la masse de bleu d’aniline contenue dans une cartouche d’encre.
c = 0,9 / 5,273 = 0,1707 mmol / L.
Volume d'une cartouche d'encre : 0,75 mL.
Volume de la fiole jaugée : 200 mL.
Facteur de dilution F = 200 / 0,75 ~267.
Par suite 0,1717 x 267 ~45,5 mmol / L~0,046 mol / L
Quantité de matière d'encre dans une cartouche : 4,55 10
-2 x 7,5 10
-4 =3,41 10
-5 mol.
Masse de bleu d'aniline
3,41 10-5 x 737,7 ~ 2,5 10-2 g = 25 mg.