1. Structure du (-) linalol.
15. Indiquer
par un astérisque la position de l'atome de carbone asymétrique en
justifiant.
16. Déterminer la configuration absolue du carbone asymétrique.
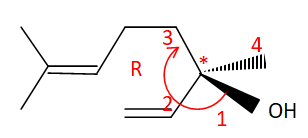 17.
17. Indiquer le caractère lévogyre ou dextrogyre de cette molécule.
Le pouvoir rotatoire du (-) linalol étant négatif ( -18±3° g
-1 cm
3 dm
-1), cette molécule est lévogyre.
Le
linalol obtenu par synyhèse est un mélange des deux formes du couple
d'énantiomères avec 50 % de l'énantiomère R et 50 % de l'énantiomère S.
18. préciser le nom d'un tel mélange et la valeur de son pouvoir rotatoire.
Le mélange est un racémique ; son pouvoir rotatoire est nul.
Etape 1 et 2 de cette synthèse.
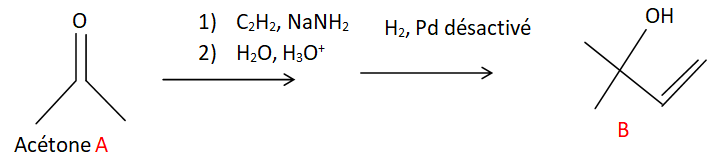 19.
19. Nommer la molécule d'acétone dans la nomenclature officielle.
3 atomes de carbone et une fonction cétone : propanone.
3.
Etape 3 : hydrobromation.
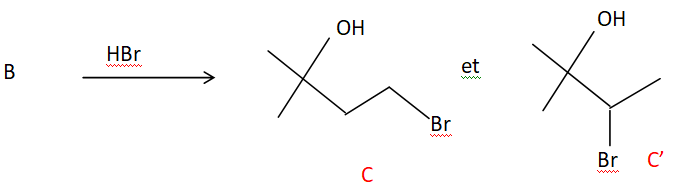
20. Indiquer le type de réaction parmi les termes suivants : élimination, substitution, addition.
Addition de HBr sur une liaison double C=C.
21. Préciser l'espèce chimique obtenue en s'appuyant sur la règle de Markovnikov.
H se fixe sur l'atome de carbone le moins substitué, donc composé C'.
En fait, cette étape d'hydrobromation se fait en présence d'un peoxyde
avec un mécanisme radicalaire et aboutit au composé C avec lequel on
poursuit la synthèse.
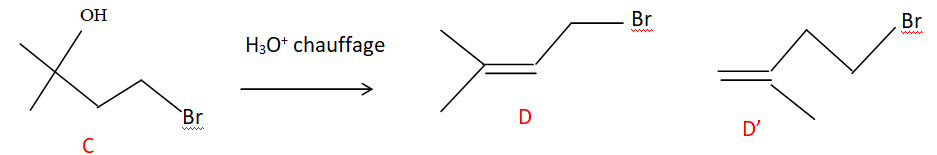
4. etape 4 : déshydratation intramoléculaire.
22. Représenter D et D'.
Règle de Zaitsev : la double liaison se forme de préférence avec le carbone le plus substitué.
 Etape 5.
Etape 5. synthèse organomagnésienne.
a. Synthèse d'un organomagnésien
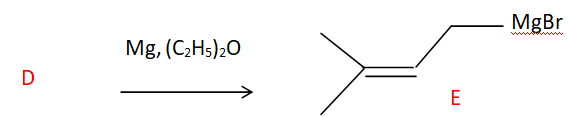
23. Justifier le caractère nucléophile du carbone dans la liaison C-Mg.
Electronégativité : Mg (1,31) ; C (2,55).
Le carbone plus électronégatif que le magnésium porte une charge
partielle négative ; le magnésium porte une charge partielle positive.
5.b.
24. Représenter la formule développée du méthanal ; préciser à quelle famille chimique il appartient.
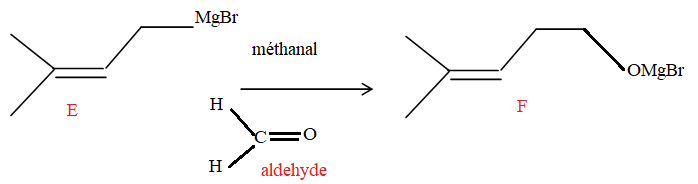 5.c
5.c Hydrolyse acide de F.
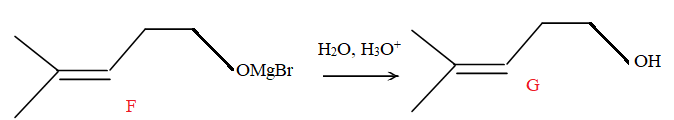 25.
25. Indiquer la
polarité de la liaison entre le carbone et l'oxygène du méthanal et en
déduire le site de cette molécule qui va subir l'attaque nucléophile de
l'organomagnésien.
Electronégativité : O ( 3,44) ; C ( 2,55).
L'oxygène plus électronégatif que le carbone porte une charge partielle
négative ; le carbone porte une charge partielle positive.
Le carbone subit l'attaque nucléophile de l'organomagnésien ; on obtient l'alcoolate magnésien, puis par hydrolyse, l'alcool.