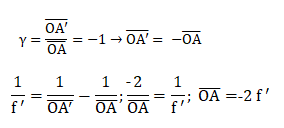....
|
PARTIE V : PHYSIQUE (50 points)
V.1 – Magnétisme
(25 points)
V.1.1 – Le champ
magnétique
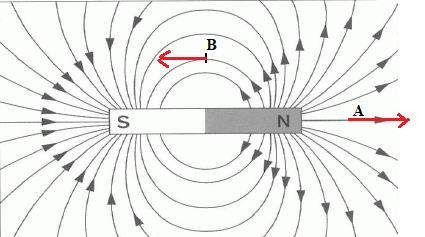
a) Représentez le
spectre magnétique d’un aimant droit ainsi que des vecteurs champs
magnétiques aux points A et B du schéma. Le champ magnétique généré par
cet aimant est-il uniforme ?
Ce champ n'est pas uniforme.
b) Citez trois
dispositifs permettant de créer un champ magnétique uniforme dans une
région de l’espace.
Aimant en forme de U, solénoïde, bobines de Helmoltz.
c) Quel appareil
permet de mesurer un champ magnétique ?
Telsamètre.
d ) Quelle est la
particularité d’un fil conducteur parcouru par un courant électrique ?
e) Le sens du champ
magnétique dépend-il du sens du courant électrique ?
Ce fil produit un champ magnétique. Il se comporte comme un aimant.
Le sens du champ magnétique
dépend du sens du courant électrique.
V.1.2 – Étude d’un
solénoïde.
Données :
Valeur du champ magnétique créé par un solénoïde en son centre : B = μ0.n.I
n : nombre de spires par mètre
μ0 : perméabilité du vide
a) Qu’est-ce qu’un
solénoïde ?
Ensemble de spires jointives connectées en série, formant un cylindre.
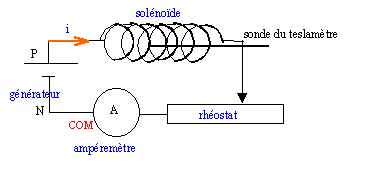
b) On souhaite
étudier la valeur B du champ magnétique créé par un solénoïde en son
centre. Ce solénoïde comporte un nombre total de spires N = 200 pour
une longueur l = 40 cm.
On fait varier la valeur de l’intensité I du courant dans le solénoïde
à l’aide d’un rhéostat et on mesure, à l’aide d’un teslamètre, la
valeur du champ magnétique. Les résultats des mesures sont consignés
dans le tableau suivant :
| I(A) |
0,0
|
0,5
|
1,0
|
1,5
|
2,0
|
2,5
|
3,0
|
B(mT)
|
0,00
|
0,31
|
0,64
|
0,96
|
1,28
|
1,60
|
1,90
|
Proposez un schéma du montage permettant de réaliser l’expérience, en
précisant le sens de branchement de l’ampèremètre.
Tracez la courbe d’évolution du champ magnétique B =
f(I).
Quel type de relation reliant B à I est mis en évidence par le graphe ?
Déterminez l’équation de la courbe obtenue.
Calculez, à l’aide de la courbe, la valeur expérimentale de la
perméabilité du vide μ0.
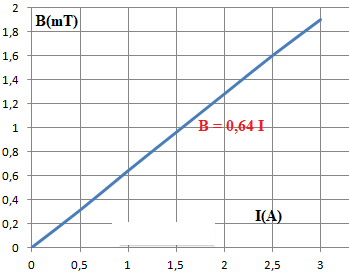
n = 200 / 0,4 =500 spires / mètre ; 0,64 10-3
= 500 µo.
µo = 1,28 10-6 m kg s-2 A-2.
V.1.3 – Étude de documents : un proton dans un
champ magnétique.
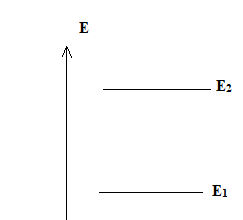
a) Donnez les 2
valeurs possibles de l’énergie que peut posséder un proton plongé dans
un champ magnétique de valeur B. On notera E1 l’énergie la
plus basse, E2 l’énergie la plus haute.
E1 = -|µ| B ; E2 = +|µ| B.
b) Représentez ces 2 valeurs sur un diagramme.
c) Rappelez la
relation entre la fréquence n de l’onde électromagnétique à imposer
pour faire passer le noyau du niveau E1 au niveau E2
et la différence d’énergie entre ces 2 niveaux DE = E2–E1.
DE = E2–E1
= h n.
d) Déterminez
l’expression DE
en fonction de μ et B et en déduire une relation entre n et B. Quel
type de relation mathématique existe-t-il ces deux grandeurs ?
Ces deux grandeurs sont proportionnelles.
E2–E1 =|µ| B. - (-|µ| B.) = 2|µ| B= h n.
e) Déterminez
l’ordre de grandeur des fréquences de résonance du proton, sachant que
l’intensité des champs magnétiques utilisés varie entre 1 et 2 teslas,
que la valeur de la constante de Planck est : h = 6,63.10-34
J.s et que pour le proton μ = 1,41.10-26 USI.
n
=2|µ| B/ h ~2 x1,41 10-26 x2 / (6,63 10-34) ~9 107
Hz.
f) Par analyse
dimensionnelle, déterminer l’unité du moment magnétique nucléaire μ.
Le moment d'une force s'exprime en N m et le champ magnétique en tesla
(T).
µ s'exprime en N m T-1.
V.2 – Optique
géométrique (25 points)
V.2.1 – On dispose
d’une lentille convergente portant l’indication 20 δ (dioptries).
Quelle est en centimètres la distance focale de la lentille ?
f ' = 1 / 20 =0,05 m = 5 cm.
V.2.2 – Vous
disposez d’une lentille convergente.
Calculer la position d’un objet pour que le grandissement de l’image
associée soit égal à -1.
Donnez la signification des termes des équations. Que signifie un
grandissement égal à –1 ?
f ' : distance focale image. A' position de l'image ; A
position de l'objet ; O centre optique.
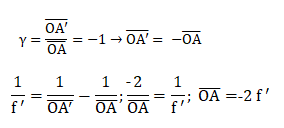
Grandissement = -1 ; l'objet et l'image ont la même dimension ; l'image
est inversée par rapport à l'objet.
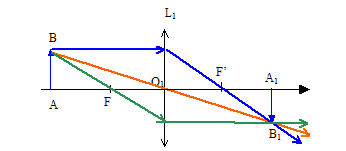
V.2.3 – Faites la
construction géométrique et tracez l’image résultante. Nommez F et F’.
F foyer principal objet ; F ' foyer principal image.
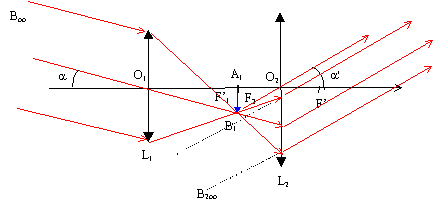
V.2.4 –
Indiquez un montage utilisant deux lentilles convergentes, donnant une
image droite (non renversée).
On portera sur le schéma l’objet AB, les 2 lentilles, leurs foyers
respectifs ainsi que les images intermédiaires et finales. Faire
apparaître une construction claire de ces images.
V.2.5 – Donnez la constitution grossière d’une
lunette astronomique. Nommer ces éléments constitutifs.
On considère une lunette
astronomique formée :
. d'un objectif constitué
d'une lentille mince convergente de distance focale f '1
> 0.
. d'un oculaire constitué
d'une lentille mince convergente de distance focale f'2 > 0.
Ces deux lentilles ont
même axe optique D.
V.2.6 – Qu’est-ce qu’une lunette
afocale ?
Une lunette afocale donne d'un objet à l'infini, une image agrandie
située à l'infini.
V.2.7 – Comment peut être considérée
la lumière venant d’un point objet situé à l’infini.
Les rayons lumineux issus de cet objet sont parallèles.
V.2.8 – Quel montage faut-il
réaliser pour simuler un objet provenant de l’infini ?
Placer sur le banc d'optique un objet dans le plan focal objet d'une
lentille. L'image de l'objet par cette lentille est située à l'infini.
V.2.9 – Qu’est-ce que
l’accommodation ?
C'est un mécanisme naturel de l'oeil pour voir à différentes distances
par contraction du muscle ciliaire.
V.2.10 – Observez
le trajet des rayons dans la lunette ci-dessous. L’oeil a-t-il besoin
d’accommoder ?
Justifiez votre réponse.
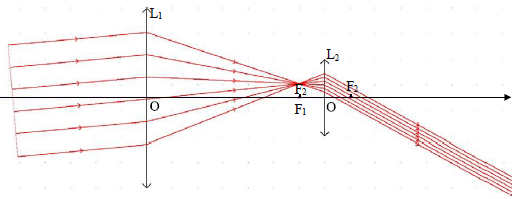
L'image définitive étant à l'infini, l'oeil observe sans fatique, sans
accommoder.
PARTIE VI
: CHIMIE (70 points)
VI.1 – Chimie des solutions
(20 points)
On se propose de doser les ions Fer (II) contenus dans un anti-mousse
pour gazon par une solution de permanganate de potassium.
VI.1.1 – Les solutions de permanganate de potassium ne sont pas stables
dans le temps. Afin de connaitre la concentration de notre solution, on
réalise son dosage à l’aide d’une solution d’oxalate de sodium Na2C2O4.
On prépare une solution V0 = 100 mL d’oxalate de sodium à partir d’une
masse m = 350 mg (solution mère). Puis on prélève V1 = 10 mL de cette
solution que l’on introduit dans un erlenmeyer de 250 mL (solution
fille) et on ajoute 20 mL d’une solution d’acide sulfurique de
concentration molaire.
On réalise le dosage ; l’équivalence est atteinte après ajout d’un
volume Veq1 = 12,6 mL de permanganate de potassium.
Données : M(Na2C2O4) = 134 g.mol-1 ; M(KMnO4) = 158,03 g.mol-1 ;
E°(MnO4-/Mn2+) = 1,51 V à pH = 0 ; E°(CO2/H2C2O4) = –0,48 V à pH = 0
a) Écrivez les demi-équations correspondantes à chaque couple.
2 fois { MnO4-+ 8 H+ + 5e- =Mn2+ + 4H2O }
5 fois {H2C2O4 = 2CO2 +2H+ + 2e- }
b) Écrivez l’équation bilan de la réaction.
2MnO4-+ 6 H+ + 5H2C2O4 = 2Mn2+ +10CO2+ 8H2O.
c) Donnez l’expression littérale de la concentration molaire en permanganate de potassium, puis faites l’application numérique.
C(H2C2O4 ) = m / (M(Na2C2O4)V0 ) = 0,350 / (134 x0,10)=2,61 10-2 mol / L.
A l'équivalence 2,5 C (MnO4-) Veq1= C(H2C2O4 )V1.
C (MnO4-) = C(H2C2O4 )V1 /(2,5 Veq1) =2,61 10-2 x10 /(2,5 x12,6)~8,3 10-3 mol / L.
d)
À partir de la valeur trouvée à la question c), proposez un mode
opératoire pour préparer 500 mL de permanganate de potassium, à cette
concentration, à partir de KMnO4 en poudre.
0,5 x8,3 10-3 = 4,15 10-3 mol.
4,15 10-3 x 158,03 =0,655 g KMnO4.
Peser 0,655 g de poudre sur une balance de précision avec coupelle tarée.
Verser dans une fiole jaugée de 500 mL contenant 1 / 3 d'au distillée. Agiter jusqu'à dissolution complète.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
e) Donnez la formule de l’acide sulfurique. À quoi sert son ajout lors du dosage ?
H2SO4. l'ion permangagante est oxydant en milieu acide et l'ion sulfate est spectateur.
f) Déterminez le nombre d’oxydation de l’élément manganèse parmi les composés suivants : MnO4-, Mn2+, MnO2.
MnO4-: n.o +4(-2) = -1 ; n.o = +VII.
Mn2+ : n.o = +II ; MnO2 : n.o+2(-2) = 0 ; n.o = +IV.
VI.1.2 – Dosage de la solution d’anti-mousse commerciale (contenant les ions Fer (II)) :
Le sulfate de Fer (II) est employé pour éliminer la mousse qui envahit
les gazons, empêchant le gazon de pousser. Pour ne pas faire trop de
dégâts, cette solution doit avoir une teneur ou concentration massique
en ions Fer (II) inférieure à 50 g.L-1.
On dilue préalablement la solution commerciale au dixième. À V2
= 10 mL de cette solution préparée, on ajoute 20 mL d’acide sulfurique
de concentration molaire à l’aide d’une éprouvette graduée. On réalise
le dosage et on obtient Veq2 = 18,4 mL.
Données : M(Fe) = 55,84 g.mol-1 ; E°(Fe3+/Fe2+) = 0,77 V à pH = 0
a) Écrivez les demi-équations correspondantes à chaque couple.
b) Écrivez l’équation bilan de la réaction.
MnO4-+ 8 H+ + 5e- =Mn2+ + 4H2O.
5 fois {Fe2+ = Fe3+ + e- }.
MnO4-+ 8 H+ + 5Fe2+ =Mn2+ + 4H2O +5Fe3+.
c) Donnez l’expression littérale de la concentration molaire en ion Fe2+ de la solution diluée, puis faites l’application numérique.
A l'équivalence 5 C (MnO4-) Veq2= C(Fe2+ )V2.
C(Fe2+ ) = 5 C (MnO4-) Veq2 /V2 =5 x8,3 10-3 x 18,4 / 10=7,6 10-2 mol / L.
d) Quelle est la concentration molaire en ion Fe2+ de la solution commerciale d’anti-mousse ?
7,6 10-2 x10=0,76 mol / L.
e) En déduire la concentration massique en ion Fe2+ de la solution commerciale et conclure.
0,76 M(Fe) =0,76 x55,84 ~43 g / L, valeur inférieure à 50 g / L, accord avec le texte.
VI.2 : Chimie organique / Biochimie (20 points)
VI.2.1 – Les acides
α-aminés jouent un rôle crucial dans la structure, le métabolisme et la
physiologie des cellules de tous les êtres vivants connus, en tant que
constituants des peptides et des protéines. Une vingtaine d’acides
aminés sont utiles au fonctionnement du corps humain ; parmi elles, on
distingue les acides aminés « essentiels » des « non-essentiels ».
a) Qu’est-ce qui distingue un acide aminé essentiel d’un non-essentiel ?
Un acide aminé essentiel ne peut pas être synthétisé par l'organisme, cela implique sue l'alimentation doit l'apporter.
b) La phénylalanine
est un acide α-aminé qui participe à la formation des protéines
alimentaires les plus courantes. C’est aussi le constituant principal
de l’aspartame, un édulcorant également utilisé dans l’industrie
alimentaire, en particulier dans les boissons gazeuses. On donne ci-
dessous sa représentation de Cram.
Entourez et nommez les différents groupes fonctionnels présents dans la phénylalanine.
Justifiez que la phénylalanine appartient à la famille des acides α-aminés
Donnez la configuration du carbone asymétrique présent dans la molécule.
Le groupe amine et le groupe carboxyle sont portés par le même carbone.
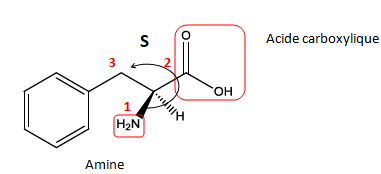
Dessinez la phénylalanine selon la représentation de Fisher et la représentation de Newman.
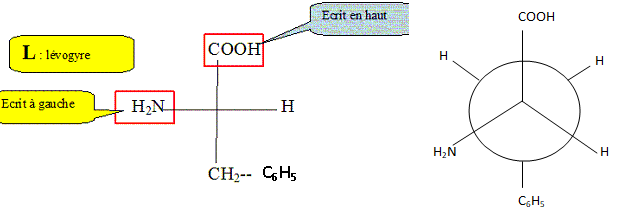
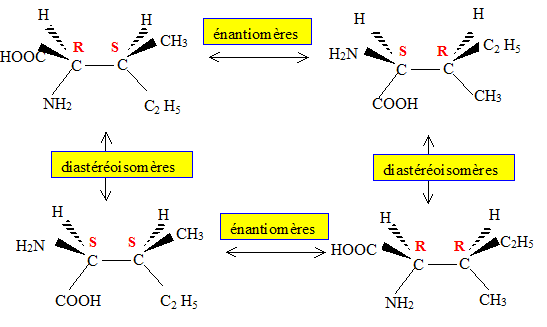
c) L’isoleucine, qui est également un acide aminé essentiel, constitue entre autres une source d’énergie pour les muscles.
Dessinez l’ensemble des isomères de configuration de l’isoleucine.
Reliez par une flèche rouge les énantiomères et par une flèche bleue
les diastéréoisomères.
VI.2.2 –
La réaction de condensation entre deux acides α-aminés donne des
dipeptides. On souhaite former à partir de phénylalanine (Phe) et
d’isoleucine (Ile) le dipeptide IlePhe.
a) Combien de
dipeptides différents peut-on obtenir à partir d’un mélange équimolaire
de phénylalanine et d’isoleucine ? Nommez-les tous en utilisant leurs
diminutifs (Phe et Ile).
4 : Phe PHe ; Phe Ile ; Ile Phe; Ile Ile.
b) La synthèse du
dipeptide IlePhe nécessite de protéger au préalable les fonctions qui
peuvent conduire aux dipeptides non désirés. Pour ce faire, on fait
dans un premier temps réagir la fonction acide carboxylique de la
phénylalanine avec du méthanol en présence d’un acide comme catalyseur.
Quel est le nom de la réaction qui a été mise en oeuvre ? Représentez la molécule obtenue.
Estérification.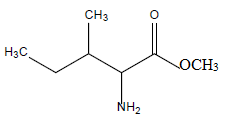
Dans cette réaction, l’acide est utilisé comme catalyseur. Expliquez ce que cela signifie.
Un catalyseur accèlère la réaction ; il n'apparaît pas dans le bilan.
c) La réaction globale de synthèse du dipeptide peut s’écrire :
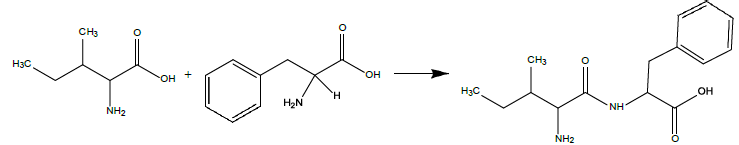
Sachant
que l’on a obtenu au final 5 g de dipeptide et que le rendement global
de la réaction a été de 80 %, déterminer les quantités de départ
d’isoleucine et de phénylalanine.
M(dipeptide) =12 x15 +22+3 x16 +14 x2=278 g / mol.
nréel = 5 / 278 =0,018 mol.
nthéorique =0,018 / 0,80 =0,0225 mol.
M(Phe))=165 g / mol ; m = 165 x0,0225 =3,7 g.
M(Ile))=131 g / mol ; m = 131 x0,0225 =2,9 g.
VI.3 : Chimie analytique (20 points)
Parmi les nombreuses méthodes de séparation des acides aminés, nous pouvons citer l’électrophorèse et l’HPLC.
VI.3.1 – Séparation par électrophorèse sur papier.
Les 2 acides aminés que l’on souhaite séparer sont la valine et l’acide glutamique.
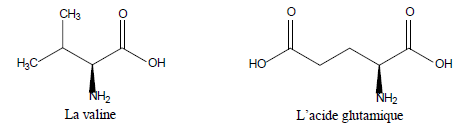
La valine possède deux pKa : l’un pour sa fonction COOH, pKa1 = 2,3, et l’autre pour sa fonction NH2, pKa2 = 9,6.
L’acide glutamique en possède trois : l’un pour sa fonction COOH en alpha de l’amine, pKa1 = 2,2 ; l’autre pour sa fonction amine, pKa2 = 9,5, et enfin un troisième pour sa seconde fonction acide, pKr = 4,3.
a) Représentez sur
deux axes orientés les domaines de prédominance des différentes formes
prises par la valine et l’acide glutamique en fonction du pH.
On note R : (CH3)2 CH-
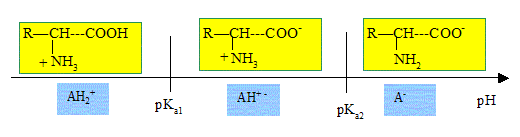
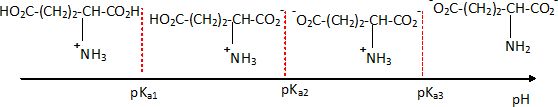
b) On réalise cette séparation dans un tampon à pH = 6,0 ; à partir des
diagrammes de prédominance des espèces, sous quelle forme se présentent
la valine et l’acide glutamique ?
Valine : AH+- ; acide glutamique : AH+ - -.
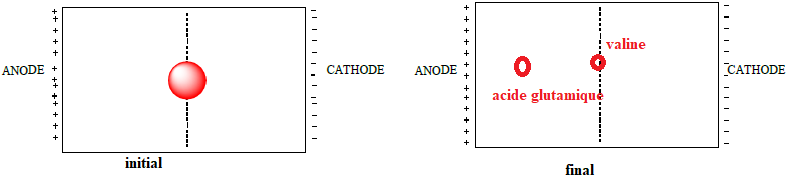
c) On a représenté ci-dessous la bande de papier où a été effectué le dépôt du mélange.
En vous aidant de votre réponse à la question b), indiquez où se
trouveront les différents acides aminés après migration
électrophorétique.
VI.3.2 – Séparation par Chromatographie Liquide Haute Performance (HPLC).
On étudie finalement la séparation de la valine et de l’acide
glutamique par HPLC dans les conditions suivantes : colonne phase
inverse C18, 5µm, 250x4 mm, éluant eau à 0,2 % de H3PO4, débit 0,7 mL.min-1, boucle d’injection 10 µL, détection UV 205 nm. On observe deux pics 1 et 2 de temps de rétention t1 = 5,5 min et t2 = 8,2 min et de largeur de pic à la base w1 = 0,25 min et w2 = 0,26 min.
a) Que signifie le terme « phase inverse » ?
Phase inverse : phase fixe apolaire ; éluant polaire ; les molécules polaires sortent en premier.
b) Attribuez à la valine et à l’acide glutamique leurs temps de rétention. Justifiez l’ordre d’élution.
L'acide glutamique étant plus polaire que la valine élue en premier ; son temps de rétention est t1 = 5,5 min.
c) Expliquez à quoi est due l’absorbance à 205 nm ?
Transition n --> p*, acide carboxilique.
d) Afin de juger de
l’efficacité de l’analyse, vous devez déterminer le nombre de plateaux
théoriques N. Quelle formule allez-vous utiliser ? Calculez N et la
hauteur équivalente à un plateau théorique H pour l’acide glutamique.
N = 16 (t1 / w1)2 =16 (5,5 / 0,25)2 =7 744.
H = L / N =250 / 7 744 ~0,032 mm.
e) Si vous devez
comparer deux conditions d’analyse différentes, la plus efficace est
celle qui donne le plus grand ou le plus petit nombre de plateaux
théoriques ?
Plus le nombre de plateaux est élevé, plus l'efficacité de la colonne est importante.
f) Comment déterminer expérimentalement le temps mort de cette analyse ?
Il faut utiliser un composé qui n'est pas retenu par la colonne et qui
éluera avec la phase mobile sans interaction avec la phase stationnaire.
VI.4 : Détermination de la structure d’une molécule (10 points)
On souhaite déterminer la structure d’une molécule A à l’aide des analyses qui ont été effectuées.
VI.4.1 – L’analyse par spectrométrie de masse par impact électronique conduit au spectre suivant :
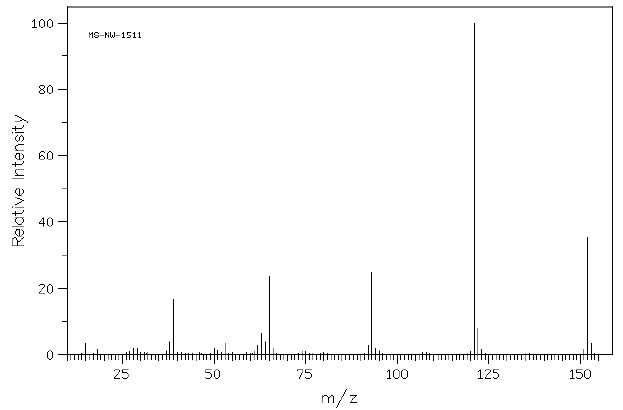
a) Que signifie le rapport m/z ?
Rapport masse sur charge.
b) Que pouvez-vous en déduire sur la masse moléculaire de A ?
M = 152 g / mol.
VI.4.2 – L’analyse centésimale de A est la suivante :
C = 63,15 % ; H = 5,26 % ; O = 31,57 %.
Déduisez-en, en utilisant la réponse à la question ci-dessus, la formule brute de A.
CxHyOz.
12 x /63,15 = y /5,26 =16z /31,57 = 152 / 100.
x = 1,52 x 63,15 / 12 ~ 8.
y = 1,52 x 5,26 ~8 ; z = 1,52 x 31,57 / 16 ~3.
C8H8O3.
VI.4.3 – L’analyse par spectrométrie RMN 1H (solvant : CDCl3) permet d’obtenir le spectre suivant :
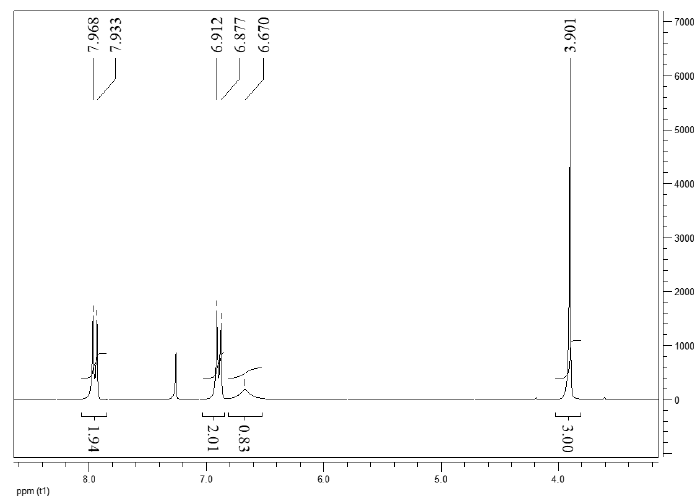
a) D’après le spectre, pensez-vous que A puisse comporter un groupement éthyle (CH2-CH3) ? Justifiez votre réponse.
Non : absence d'un triplet ( correspondant à CH3) et d'un quadruplet ( correspondant à CH2).
b) Sachant que le spectre 1H a été mesuré à une fréquence de 250 MHz,
complétez le tableau suivant (on ne tiendra pas compte du pic du CDCl3
à 7,26 ppm).
|
Déplacement chimique (ppm) |
3,9
|
6,67
|
6,89
|
7,948 |
| Déplacement chimique (Hz) |
975
|
1667,5
|
1722,5
|
1987
|
|
|
Multiplicité |
singulet
|
s large
|
doublet |
d
|
|
VI.4.4 – L’analyse par spectrométrie d’absorption IR conduit au spectre suivant :
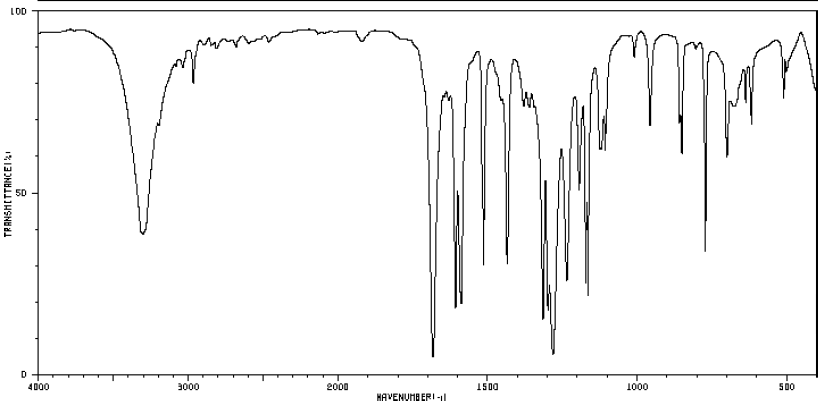
a) Comment procéderiez-vous pour effectuer cette analyse si A est un liquide ? Un solide ?
Un solide est broyé en présence de bromure de potassium.
Un liquide est déposé entre deux pastilles de chlorure de sodium
monocristallin comprimées ou placé dans une cuve dont les fenêtres sont
des monocristaux de chlorure de sodium ou de fluorure de calcium.
b)
On peut noter dans ce spectre des bandes caractéristiques à 1600, 1700,
2850 et 3400 cm-1. Déterminer à quelles
fonctions chimiques ces bandes pourraient correspondre.
1600 : C=C ; 1700 : C=O ; 2850 : Csp3-H ; 3400 :O-H alcool.
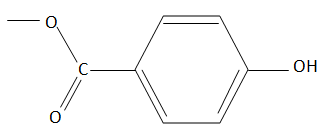
VI.4.5 – Déterminez à partir de l’ensemble des informations obtenues précédemment la structure de la molécule A.
|