Chimie
générale, concours TSPEI 2015.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Exercice 1.
Consommation d'un véhicule : 8,20 L aux 100 km. Emission CO2 : 194 g / km.
L'essence est considérée comme un mélange d'isomères d'octane C8H18 de densité d = 0,760.
1. Ecrire l'équation de la réaction de combustion complète de l'octane dans le dioxygène.
C8H18 + 12,5O2 ---> 8 CO2 + 9H2O.
2. Déterminer la masse m1 d'octane consommée en un kilomètre.
8,20 x0,76 / 100 =0,06232 kg ~ 62 g.
3. En déduire la quantité de matière d'octane.
M = 12 x 8 +18 =114 g / mol ; 62,32 / 114 =0,547 mol.
4. Déterminer la quantité de matière puis la masse de CO2 émise. Conclure.
n(CO2) = 8 x0,547 ~4,37 mol soit 4,37 x44 ~192 g.
Cette valeur est en accord avec la fiche technique ( 194 g / km).
Exercice 2.
Les
esters méthyliques ont remplacés le plomb dans les carburants. Ils
peuvent être mélangés avec des teneurs allant jusqu'à 5 % en masse. On
introduit dans un ballon V1 = 5,0 mL de gazole, 15 mL d'éthanol et exactement VB = 2,5 mL de solution de soude de concentration CB = 1,00 mol / L. Après refroidissement la solution est dosée par une solution dacide chlorhydrique de concentration CA = 0,100 mol / L en présence de phénolphtaléine.
1.a. Quel est le rôle de l'éthanol.
C'est le solvant.
1.b. Indiquer la verrerie utilisée pour prélever le gazole, l'éthanol et la soude.
Gazole et éthanol , volumes peu précis : éprouvette graduée.
Soude, volume précis : pipette jaugée.
1.c Quel est le rôle de la phénolphtaléine ?
Indicateur de fin de réaction dans le titrage acide base.
2.a. Ecrire l'équation de la réaction de dosage entre l'acide chlorhydrique et la soude.
H3O+aq +HO-aq --> 2H2O(l).
2.b. Le volume équivalent est Véq =17,7 mL. Calculer la quantité d'ester n1 contenue dans le gazole.
Quantité de matière de soude restante : CA Véq =0,100 x17,7 = 1,77 mmol.
Quantité de matière initiale de soude :1,00 x2,5 = 2,5 mmol.
Quantité de matière d'ester ayant réagi avec la soude :
2,5 -1,77 =0,73 mmol.
R-COOCH3 + HO- --> RCOO- + CH3OH.
n1 = 0,73 mmol.
2.c. La densité du gazole est 0,84 et la formule de l'ester est C19H34O2. Calculer le pourcentage massique de l'ester dans le gazole.
M(ester) = 19 x12 +34 +32=294 g/mol ; masse d'ester :294 x0,73 10-3 =0,215 g.
Masse de gazole : 5 x0,84 =4,2 g.
% massique d'ester : 0,215 x 100 / 4,2 =5,1 %.
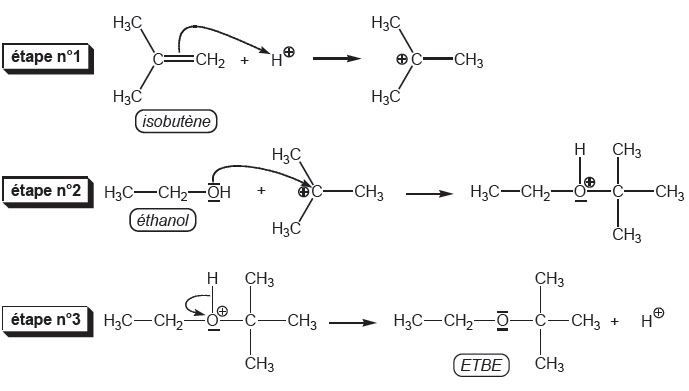
3. L'ETBE ajouté au
carburant est synthétisé par réaction de l'éthanol avec le
2-méthylpropène en présence d'acide comme catalyseur.
3.a et b. Donner les formules semi-développées de l'éthanol et du 2-méthylpropène. Ecrire l'équation de la réaction.
3.c Donner un mécanisme réactionnel par analogie avec l'hydratation d'un alcène.
|
...
|
....
|
Exercice 3.
Le lithium est utilisé dans les piles. L'isotope le plus abondant est 73Li.
1. Donner la composition d'un atome de lithium.
3 élctrons ; 3 protons et 7-3 = 4 neutrons.
2. Définir isotope.
Deux isotopes ne se différencient que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
3. Où se situe le lithium dans le tableau périodique ? A quelle famille appartient-il ? Citer un autre élément de cette famille.
Famille des alcalins ( première colonne du tableau périodique).
Sodium, potassium.
4. Donner sa configuration électronique.
1s2 2s1.
5. Quel ion peut-il former ? Justifier.
Li+. En perdant un électron, la couche électronique externe de l'ion est complète ( règle du duet ou de l'octet).
6. Comment évolue le caractère réducteur d'un élément dans la classification périodique ? Que dire du lithium.
Le caractère réducteur diminue dans une même famille en
descendant la colonne du tableau ainsi qu'en se déplaçant de gauche à
droite dans une même ligne du tableau.
Le lithium est un réducteur très fort.
7. Le lithium cristallise dans le système cubique centré.
Représenter la maille. Combien d'atomes sont présents dans une maille ?
Exprimer la relation entre rayon r d'un atome et l'arête a de la maille.
Sachant que a = 0,35 nm, calculer r.
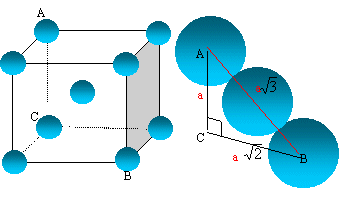
La tangence s'effectue suivant la grande diagonale du cube : a racine carrée
(3) = 4rLi.
r =0,35 x1,732 / 4 ~0,15 nm.
Les 8 atomes situés aux sommets du cube sont communs à 8 mailles et
comptent pour 1/8=0,125.
Celui du centre, commun à une seule maille, compte pour une unité.
Nombre d'atomes de lithium appartenant à la maille : 8* 0,125 +1 = 2.
Exercice IV. Synthèse de l'ammoniac en phase gazeuse.
N2(g) + 3H2(g) =2NH3(g).
1. Justifier pourquoi l'enthalpie standard de formation de N2(g) et H2(g) sont nulles à 298 K.
L'enthalpie standart de formation à T, d'un corps simple stable à la
température T considérée, est nulle : c'est la réaction de
formation de ce corps à partir de lui même.
2. Calculer à 298 K l'enthalpie standard de cette réaction et commenter son signe.
Calculer à 298 K l'entropie standard de cette réaction. Pouvait-on prévoir son signe ?
DrH° = 2 DfH°(NH3) - 3 DfH°(H2) - DfH°(N2) = 2(-46,2 ) = -92,4 kJ mol-1.
DrH° < 0, réaction exothermique.
DrS° = 2 S°(NH3) - 3 S°(H2) - S°(N2) = 2(-46,2 ) = 2x192,5 -3 x130,6-191,5 = -198,3J mol-1K-1.
Le signe était prévisible, on passe de 4 molécules initiales à 2
molécules au final. Le système est plus ordonné dans l'état final.
3. Quelle est l'influence d'une élévation de pression à température constante sur cet équilibre. Justifier.
L'état final compte 2 molécules contre 4 à l'état initial. Une
augmentation de pression à T constante déplace l'équilibre dans le sens
direct.
4. Quelle est l'influence d'une augmentation de température à pression constante ? Justifier.
La réaction étant exothermique, une élévation de température à P constante, déplace l'équilibre dans le sens indirect.
5. Donner dans le
cadre de l'approximation d'Ellingham, l'expression de l'enthalpie libre
standard de réaction en fonction de la température.
DrG° = DrH° -T DrS°.
DrG° =-92,4 103 +198,3 T.
6. Déterminer la valeur de la constante d'équilibre à 0°C et à 450°C.
A 298 K : DrG° =-92,4 103 +198,3 x298 =-3,33 104.
DrG° = -RT ln K ; ln K = 3,33 104 / (8,314 x298)~13,5 ; K = 7,1 105.
A 723 K : DrG° =-92,4 103 +198,3 x723 =5,1 104.
DrG° = -RT ln K ; ln K = -5,1 104 / (8,314 x723)~ -8,5 ; K = 2,1 10-4.
7. La synthèse de l'ammoniac est réalisée à 450°C. Justifier ce choix.
A basse température, on atteint plus lentement l'équilibre.
On
utilise un catalyseur, on travaille vers 450°C et on retire
régulièrement de l'ammoniac afin de déplacer l'équilibre vers la droite.
8. A une pression P et à 450°C, K = 2,1 10-4.
a. Exprimer la constante d'équilibre en fonction des pressions partielles des espèces et de P0 pression standard.
K = P2NH3 P02/ (P3H2 PN2).
b. On part d'un mélange stoechiométriique de N2 et H2. On appelle n0 le nombre de moles initiales de N2 et a le coefficient de dissociation de N2 à l'équilibre. Etablir le tableau d'avancement et en déduire le nombre total nT de moles gazeuse à l'équilibre.
|
avancement (mol)
|
N2(g)
|
+ 3H2(g) |
=2NH3(g). |
initial
|
0
|
n0
|
3n0 |
0
|
en cours
|
x
|
n0-x |
3( n0-x) |
2x
|
à l'équilibre
|
xéq
|
n0-xéq |
3( n0-xéq) |
2xéq |
nT = 4n0-2xéq=2n0 ( 2-xéq/ n0)=2n0 ( 2-a).
c. En déduire l'expression des pressions partielles à l'équilibre.
PNH3 =2xéq P / (nT P0)=2xéq P / (2n0 ( 2-a) P0)= a P / [( 2-a)P0].
PH2 =3( n0-xéq) P / (nT P0) = 3( n0-xéq) P / (2n0 ( 2-a) P0) = 3( 1-a) P / [2 ( 2-a) P0)].
PN2 =( n0-xéq) P / (nT P0) = ( n0-xéq) P / (2n0 ( 2-a) P0) = ( 1-a) P / [2 ( 2-a) P0)].
d. Montrer que K = 16a2(2-a)2P02 / [27(1-a)4P2].
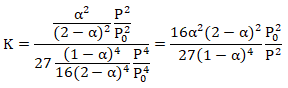
e. Si a =0,52 à 450°C calculer P.
2,1 10-4 =16 x 0,522 x1,482 P02 / [27 x 0,484 P2].
2,1 10-4 =9,476 P02 / [1,433 P2].
2,1 10-4 =6,61 P02 / P2.
P2=3,15 104P02 ; P =177 P0.
|
|
|
|