Le
dihydrogène est un vecteur énergétique qui pourrait avantageusement
remplacer les carburants carbonés,
puisqu’il est sans émission de gaz à effet de serre. Cependant, il n’en
existe pas de sources naturelles
significatives et il est donc nécessaire de le fabriquer pour envisager
son utilisation. Les modes de production
actuels du dihydrogène reposent essentiellement sur le traitement
thermochimique de produits pétroliers,
qui produisent notamment du dioxyde de carbone. Une voie alternative
d’obtention du dihydrogène consiste
à réaliser l’électrolyse de l’eau.
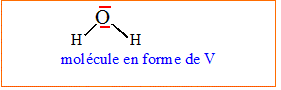
1- Représenter le
schéma de Lewis de la molécule d’eau.
L’électrolyse vise à réaliser la transformation inverse de la
synthèse de
l’eau :
H
2 (gaz) + ½ O
2 (gaz) = H
2O(liquide).
Cette transformation ne peut avoir lieu spontanément. Pour la
forcer, de
l’énergie est apportée par un générateur permettant d’imposer un
courant
et de maintenir son intensité I constante.
Le montage de principe est schématisé ci-dessous.
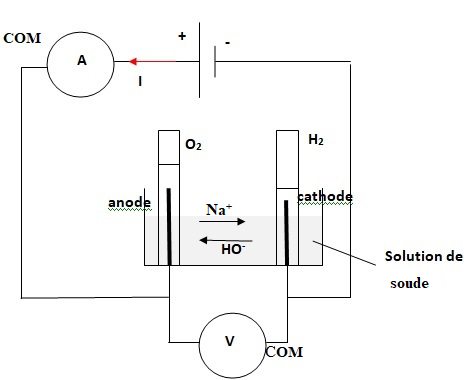
II-2- L’électrolyte est
constitué d’une solution aqueuse d’hydroxyde de sodium : NaOH, à la
concentration 0,50 mol.L
-1. Déterminer le pH de
l’électrolyte.
[H
3O
+] = 10
-14 / [HO
- ] = 10
-14
/ 0,5 =2 10
-14 mol / L
pH = -log(2 10
-14)=13,7.
II-3- Compléter
le schéma en indiquant par des flèches :
a. Le sens du courant qui traverse le circuit.
b. Les sens de déplacement des différents ions en solution..
Lors du fonctionnement de l’électrolyseur, il se produit des
dégagements gazeux sur chacune des deux
électrodes, dûs aux transformations électrochimiques suivantes :
a) 4 H
2O + 4 e
- --> 2 H
2 + 4 HO
-
b) 4 HO
- --> O
2 + 2 H
2O + 4 e
-
II-4- Préciser, pour chaque électrode, sa polarité,
la nature du gaz dégagé et le type de transformation
électrochimique (oxydation ou réduction) qu’il s’y produit.
Réduction de l'eau en dihydrogène à la cathode négative.
4 H2O
+ 4 e- --> 2 H2 + 4 HO-
Oxydation de l'eau en dioxygène à l'anode positive.
4 HO
- --> O
2 + 2 H
2O
+ 4 e
-
II-5-a- Exprimer la
quantité d’électricité Q (en C) mise en œuvre au cours de l’électrolyse
en fonction de
l’intensité I (en A) du courant et de la durée
Dt (en s) de l’électrolyse.
Q = I
Dt.
II-5-b- Exprimer la
quantité n(H
2) (en mol) produite en fonction de Q.
Quantité de matière d'électrons n(e
-) = Q / F.
n(H
2) = 0,5
n(e-)
= 0,5 Q / F.
II-5-c- Calculer la
quantité n(H
2) produite lors d’une électrolyse menée à
intensité constante I = 2,0 A
pendant 50 minutes.
Q = 2,0 x 50 x60 =6,0 10
3 C.
n(H2)
=0,5 x6,0 103 / 96500 =0,031 mol.
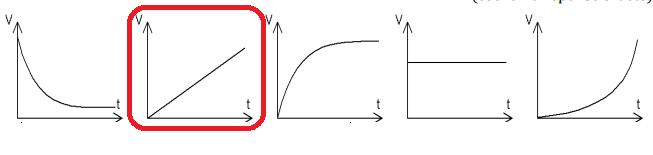
II-6- Cocher le graphe
représentant, à température T et pression P constantes, l’évolution du
volume V de
H
2 dégagé en fonction du temps t.
Loi des gaz parfaits PV = n(H
2)RT ;
V =
n(H2)RT /
P.
n(H2)
=0,5 Q
/ F = 0,5 I Dt / F.
A
P et T constants, V est proportionnel au temps t.
II-7-
Quelle masse d’eau faut-il électrolyser pour obtenir une tonne (soit
1000 kg) de dihydrogène ?
n(H
2 ) =1,0 10
6 / M(H
2) =
1,0 106 / 2 = 5,0 105
mol.
H2O(liquide)
=
H2 (gaz) + ½ O2 (gaz).
n(eau) = n(H2 ) =5,0 105
mol.
Masse d'eau = 5,0 105 M(H2O) = 5,0 105
x18 =9,0 106 g = 9,0 tonnes.