L'érythrosine,
colorant alimentaire, bac Centres étrangers
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Concentration de l'érythrosine dans la solution.
1. Proposer une longueur d'onde à laquelle régler le spectrophotomètre.
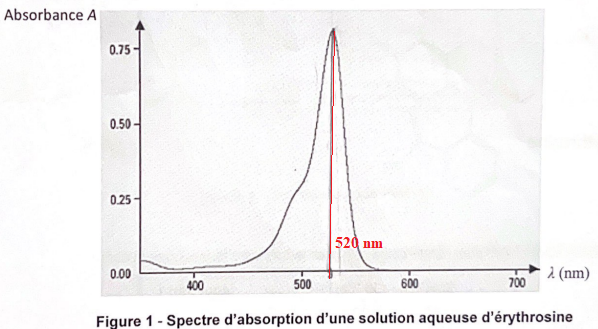 Pour une meilleure précision on se place au maximum d'absorption : 520 nm..
2.
A partir de la loi de Beer-Lambert, montrer que la mesure de
l'absorbance de la solution permet de déterminer la concentration en
érythrosine.
Aux faibles concentrations, l'absorbance et la concentration sont proportionnelles. .
3. Montrer que la concentration en érythrosine est 5,4 10-6 mol / L.
Coefficient d'absorption molaire de ce colorant e =8,2 104 L mol-1 cm-1 ; longueur de la cuve L = 1,0 cm ;
Asolution = 0,44.
Loi de Beer-lambert : A = e L C ; C = A / (e L) =0,44 / (8,2 104) =5,4 10-6 mol / L.
4.
Montrer qu'une personne de 50 kg peut consommer la totalité de la
solution contenue dans la conserve de cerises sans risque pour sa santé.
DJA = 0,1 mg / kg de masse corporelle par jour.
M(érythrosine) = 879,86 g / mol.
Volume de la solution d'érythrosine extrait de la boîte de conserve V = 500 mL.
Quantité de matière d'érythrosine contenue dans 500 L : 2,7 10-6 mol.
Masse d'érythrosine : 2,7 10-6 x 879,86 =2,38 10-3 g = 2,38 mg.
Masse d'érythrosine / masse corporelle = 2,38 / 50 ~0,05 mg / kg, valeur inférieure à la DJA ( donc aucun risque).
|
...
|
....
|
Cinétique de la décoloration de l'érythrosine par l'eau de Javel..
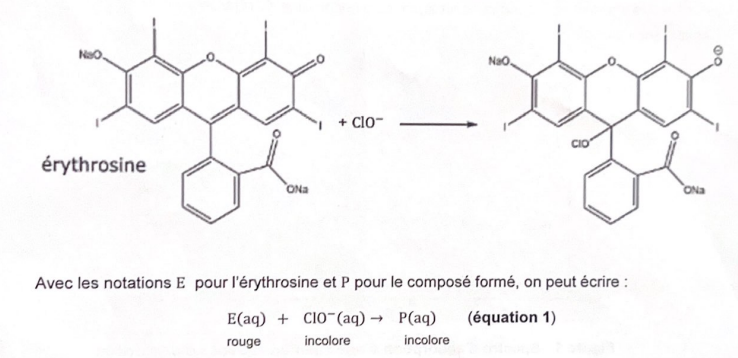
Pour préparer la solution d'eau de Javel, on utilise une solution commerciale S0 d'eau de Javel contenant 4,8 % en masse d'ion hypochlorite.
On prélève V0 = 30 mL de cette solution que l'on verse dans
une fiole jaugée de volume Vj=100 mL et on complète jusqu'au trait de
jauge. On obtient la solution S1.
A la date t =0 s, on mélange V1 = 5 mL de solution S1 avec VE = 5 mL de solution d'éryhtrosine de concentration déterminée à la question 3 et on mesure l'absorbance au cours du temps.
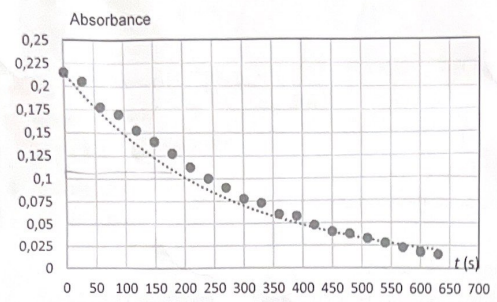
On a superposé en pointillés aux poits expérimentaux, la courbe de modélisation d'équation A = 0,215 exp(-0,0036t).
5. Montrer que la concentration en ion hypochlorite de la solution S1 est c1 = 0,31 mol / L.
Masse volumique de l'eau de Javel : r = 1095 g / L.
Masse d'ion hypochlorite ClO- dans 1 L :1095 x4,8 / 100 =52,56 g.
M(ClO-) = 35,5 +16 =51,5 g / mol.
n(ClO-) =52,56 / 51,5 =1,02 mol dans 1 L de S0.
Facteur de dilution F =Vj /V0 = 100 / 30 =3,33.
C1 = C0 / F = 1,02 / 3,33 ~ 0,31 mol / L.
6. Montrer que les ions hypochlorite sont en excès.
n(ClO-) =C1 V1 =0,31x 5 / 1000 =1,6 10-3 mol.
n(E) =CE VE =5,4 10-6 x 5 / 1000 =2,7 10-8 mol.
2,7 10-8 mol de E réagit avec 2,7 10-8 mol d'ion hypochlorite ; ils sont en large excès et E est en défaut.
7. 8. Définir la vitesse volumique de disparition de E;exprimer cette vitesse dans le cas d'une réaction d'ordre 1
v = - d[E] / dt.
v = k[E] avec k une constante positive.
L'équation différentielle satisfaite par (E] s'écrit : d[E] / dt +k(E]=0. Les solutions de cette équation sont : [E](t) = [E0] exp(-kt).
9. Montrer que le temps de demi-réaction est donné par t½ = ln(2) / k.
[E](t½) = [E0] / 2 = [E0] exp(-kt½).
0,5 = exp(-kt½) ; ln (0,5) = - ln(2) = -kt½ ; t½ = ln(2) / k.
10. Montrer que si
la décoloration de E suit une loi de vitesse d'ordre 1, alors
l'évolution de l'absorbance en fonction du temps est une exponentielle.
A= [E] e L= [E0] e L exp(-kt).
11. Déterminer t½ et conclure.
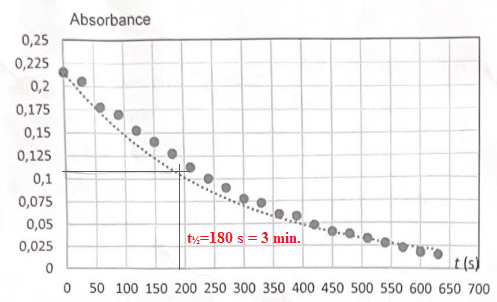
La décoloration est assez rapide.
|
|