Etude
d'une chaufferette. Bac Métropole 09 / 2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Les
chaufferettes sont de petites pochettes très pratiques à glisser dans
les poches d’un manteau ou dans les gants pour se réchauffer en hiver
car elles permettent de dégager de l’énergie thermique pendant une
durée limitée.
Le dispositif étudié dans cet exercice est constitué d’une pochette en
plastique contenant une pastille métallique et une solution aqueuse
très concentrée d’éthanoate de sodium. Dans ces conditions, il suffit
de tordre la pastille pour que l’éthanoate de sodium précipite. Cette
transformation est exothermique.
Après utilisation, on peut « régénérer » la chaufferette en la
chauffant, au bain-marie par exemple, et en la laissant doucement
refroidir sans perturbation pour éviter la précipitation.
Cet exercice a pour objectif de déterminer, à l’aide d’un titrage suivi
par conductimétrie, le titre massique en éthanoate de sodium du contenu
d’une chaufferette commerciale.
À partir de la solution d’éthanoate de sodium ( Na+; CH3CO2
– ) présente dans la chaufferette, on prépare
50,0 mL de solution diluée 25 fois. On note S la solution obtenue.
Q1. Décrire le
protocole expérimental permettant de préparer la solution S. Indiquer,
en justifiant, les volumes de la verrerie utilisée.
Facteur de dilution F = 25 ; volume de la fiole jaugée : 50,0 mL ;
volume de la pipette jaugée 50 / 25 = 2,0 mL.
Dans une fiole jaugée de 500 mL contenant 1 /3 d'eau distilée,
introduite 2,0 mL de solution d'éthanoate de sodium prélevé à la
pipette jaugée. Agiter. Compléter avec de l'eau distillée jusqu'au
trait de jauge. Boucher et agiter pour rendre homogène.
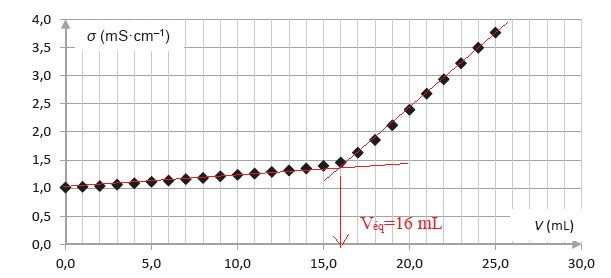
On réalise un titrage avec suivi conductimétrique de la solution S.
Pour cela un volume VS = 10,0 mL de
solution S est prélevé puis versé dans un bécher auquel sont ajoutés
environ 250 mL d’eau distillée.
L’ensemble est alors titré par une solution aqueuse titrante d’acide
chlorhydrique de concentration C = 2,0×10–1 mol·L–1.
La réaction support du titrage a pour équation : CH3CO2
– (aq) + H3O+(aq) → CH3CO2H(aq)
+ H2O(ℓ).
La conductivité de la solution contenue dans le bécher est
mesurée après chaque ajout de solution aqueuse
titrante d’acide chlorhydrique. Les résultats expérimentaux obtenus
sont reproduits en figure 1 ci-dessous.
Q2.
Reproduire sur la copie le tableau ci-dessous. Décrire, dans chacune
des cases, l’évolution des concentrations des ions dans le bécher
lorsque l’on ajoute de l’acide chlorhydrique en utilisant les
termesconcentrations des ions dans le bécher lorsque l’on ajoute de
l’acide chlorhydrique en utilisant les termes
suivants :
- « reste constante » ; - « reste négligeable » ; - « augmente » ; - «
diminue ».
On néglige l’effet de dilution dû à l’ajout de la solution d’acide
chlorhydrique dans le bécher.
concentration
|
avant
l'équivalence
|
après
l'équivalence
|
[Na+]
espèce présente dans la réaction titrée
|
« reste constante » |
« reste constante » |
[CH3CO2
–] l'un des réactif
|
« diminue » |
en défaut « reste négligeable » |
[H3O+]
l'autre réactif
|
en défaut « reste négligeable » |
en excès « augmente » |
[Cl-]
ion spectateur apporté par la solution titrante
|
« augmente » |
« augmente » |
Q3.
En utilisant les conductivités molaires ioniques des espèces présentes,
justifier sans calcul l’allure de la
courbe de la figure ci-dessous.
Avant
l'équivalence : [H3O+]
en défaut. Du point de vue de la conductivité, tout se passe comme si
on remplaçait l'ion éthanoate par l'ion chlorure de conductivité molaire
ionique plus grande. La conductivité de la solution croît.
Après
l'équivalence : [H3O+]
en excès et on ajoute des ions Cl-. La
conductivité de la solution croît plus rapidement..
Q4. Déterminer, en
justifiant à l’aide d’un schéma, la valeur du volume de solution
aqueuse titrante versé à l’équivalence du titrage.
Q5. Justifier que
la solution contenue dans la chaufferette est sursaturée, c’est-à-dire
que sa concentration en
masse de soluté est supérieure à sa solubilité s = 365 g / L.
A l'équivalence n(éthanoate ) = n(H3O+) =C Véq = 0,20 x16 =
3,2 mmol dans 10 mL de solution S.
[éthanoate de sodium] =3,2 / 10 = 0,32 mol / L.
Prendre en compte la dilution : 0,32 x 25 =8 mol / L.
M(éthanoate de sodium) =82 g / mol.
8 *82 = 656 g / L, valeur supérieure à s..
|