1. Quelques propriétés de l’acide ascorbique
Q1. Représenter la formule semi-développée de l’acide ascorbique puis nommer les familles fonctionnelles
associées aux groupes A et B entourés sur la formule topologique.
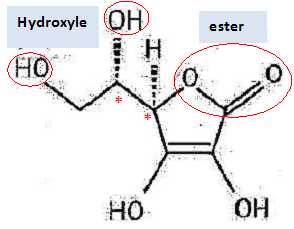 Q2.
Q2. Justifier que le spectre infrarouge est compatible avec la structure de l’acide ascorbique.
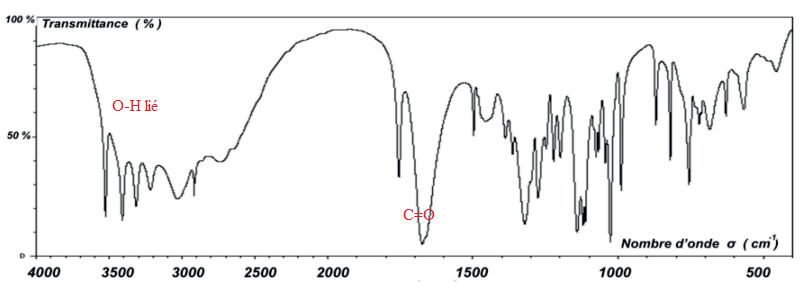
Pour étudier les propriétés acidobasiques de la vitamine C, on dissout 1,0 g d’acide ascorbique commercial
dans une fiole jaugée de 50 mL puis on complète jusqu’au trait de jauge avec de l’eau distillée. La mesure
du pH de la solution donne pH = 2,6.
Q3. Déterminer la quantité de matière initiale n
0 d’acide ascorbique introduite dans la fiole jaugée.
M(acide ascorbique) =176 g / mol.
n = m / M = 1,0 / 176 =5,68 10
-3 ~5,7 10
-3 mol.
La transformation entre l’acide ascorbique et l’eau est modélisée par la réaction d’équation :
C
6H
8O
6(aq) + H
2O(ℓ) ⇆ C
6H
7O
6
–
(aq) + H
3O
+
(aq)
Q4. Donner la définition d’un acide faible.
Un acide faible réagit partiellement avec l'eau. On aboutit à un équilibre chimique.
Q5. Montrer que l’acide ascorbique est un acide faible dans l’eau.
C =
5,7 10-3 / 0,050=0,114 mol / L
Dans l'hypothèse d'un acide fort : pH = -log (C) = -log(5,7 10
-3 / 0,050)= 0,94.
Or le pH mesuré vaut 2,6. L'acide ascorbique est un acide faible.
Q6. Donner l’expression de la constante d’acidité Ka du couple associé à l’acide ascorbique en fonction des
concentrations à l’équilibre et de la concentration standard c° puis montrer que la
valeur du pKa est proche de 4,2.
Ka = [
C6H7O6
–
(aq) ] [H3O+
(aq) ] / ([ C6H8O6(aq)] c°).
Ka ~[H3O+
(aq) ]2 / C =(10-2,6)2 /0,114=5,53 10-5 ; pKa = - log(5,53 10-5)~4,2.
2. Acide ascorbique dans un kiwi jaune
Pour déterminer la concentration en acide ascorbique d’un kiwi jaune, on le mixe jusqu’à en obtenir du jus
dont le pH est de 3,5.
Q7. Déterminer l’espèce acide-base prédominante associée à l’acide ascorbique présente dans le jus d’un
kiwi jaune.
A pH < pKa, la forme acide ascorbique prédomine. L'ion ascorbate est minoritaire.
La quantité d’acide ascorbique présent dans un kiwi jaune est déterminée à l’aide d’un dosage par excès. Le
principe de ce dosage est le suivant :
- on met le jus de kiwi en présence d’une quantité connue de diiode I
2. Seul l’acide ascorbique réagit
avec le diiode, introduit en excès ;
- on détermine ensuite par titrage la quantité de diiode restant ;
- on en déduit alors la quantité d’acide ascorbique dans le kiwi jaune.
Protocole du dosage
Étape 1 : réaction de l’acide ascorbique avec le diiode.
Introduire la totalité du jus d’un kiwi jaune mixé dans une fiole jaugée de 250 mL, puis compléter avec de l’eau
distillée jusqu’au trait de jauge. On appelle S la solution ainsi obtenue.
Introduire dans un erlenmeyer un volume V = 50,0 mL de la solution S, ainsi qu’un volume V
1 = 20,0 mL d’une
solution aqueuse de diiode I
2 à la concentration C
1 = 2,9×10
–2 mol∙L
–1
.
Cette transformation peut être modélisée par la réaction d’équation suivante :
C6H8O6 aq+ I2
aq= C6H6O6 aq+ 2H+
aq+
2I- aq.(
1)
Étape 2 : titrage du diiode restant par les ions thiosulfate S
2O
32–
Titrer le contenu de l’erlenmeyer préparé lors de l’étape 1 par une solution aqueuse de thiosulfate de sodium
de concentration C
2 = 5,00×10
–2 mol∙L
–1
, en présence d’un indicateur coloré spécifique au diiode.
On obtient un volume à l’équivalence V
2 = 16,5 mL.
La transformation mise en jeu lors du titrage peut être modélisée par la réaction d’équation suivante :
2S2O32-
aq+I2aq= S4O62-aq +
2I-aq
.(
2)
Q8. En exploitant le résultat du titrage, montrer que la quantité de matière de diiode dosé lors de l’étape 2 est
égale à 4,13×10
−4 mol.
A l'équivalence n(
S2O32-) =C
2V
2 = 5,00 10
-2 x16,5=0,825 mmol.
n(I
2) =0,5
n(S2O32-) =0,825 / 2 ~0,413 mmol = 4,13×10−4 mol.
Q9. Après avoir calculé la masse d’acide ascorbique contenue dans un kiwi jaune, déterminer combien il
faudrait en manger pour satisfaire les besoins journaliers en acide ascorbique d’un adulte (110 mg / jour)..
Etape 1 : n(I
2 )total = V
1C
1 = 20,0 x 2,9 10
-2 =0,58 mmol.
n(I
2) ayant réagi à l'étape 1 : 0,58-0,413 = 0,167 mmol.
n(acide ascorbique) = 0,167 mmol dans 50 mL de la solution S.
0,167 x5=0,835 mmol dans 250 mL de S, donc dans le jus de kiwi.
Masse correspondante : 0,835 x176=147 mg.
Il suffit de manger un kiwi jaune.
.
Le même dosage est réalisé avec un kiwi vert de même masse. On obtient un nouveau volume à l’équivalence
pour le titrage du diiode restant V ’
2 = 19,7 mL.
Q10. Expliquer sans calcul si le kiwi vert contient plus ou moins d’acide ascorbique que le kiwi jaune.
V'
2 > V
2, il reste davantage de diiode à l'issue de l'étape 1 : donc le kiwi vert contient moins d'acide ascorbique que le jaune.