Un
chimiste qui mérite d'être connu, Karl Friedrich Mohr, bac Polynésie
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
A. Le sel de Mohr.
Les
ions fer (II) sont facilement oxydés en ions fer (III) par le dioxygène
de l'air dissout en solution aqueuse. Pour minimiser cette oxydation,
Mohr utilise un solide ionique (NH4)2 Fe(SO4)2, 6H2O(s).
1. Ecrire les demi-équations électroniques relatives aux couples Fe3+aq / Fe2+aq et O2aq / H2O(l).
4 fois {Fe2+aq --> Fe3+aq+ e-}
O2aq + 4H+aq + 4e- --> 2H2O(l)
Ajouter : 4Fe2+aq +O2aq + 4H+aq + 4e- --> 4Fe3+aq+ 4e- +2H2O(l).
Simplifier : 4Fe2+aq +O2aq + 4H+aq --> 4Fe3+aq +2H2O(l).
On prépare V = 100,0 mL d'une solution de sel de Mohr en dissolvant m = 2,00 g de ce solide.
2. Vérifier que la masse molaire du sel de Mohr est M = 392,0 g / mol.
M = 2 x(14 +4) +56+2 x(32 +4x16) +6 x18 =392,0 g / mol.
3. Calculer la concentration C en soluté apporté.
n = m / M = 2,00 / 392,0 =0,0051 mol.
C = n / V =0,0051 / 0,100 = 0,051 mol / L.
(NH4)2 Fe(SO4)2, 6H2O(s)--> 2NH4+aq + Fe2+aq +2SO42-aq + 6H2O(l).
On en déduit [Fe2+] = C =0,051 mol / L.
Le chauffage à reflux.
Pour
réaliser la synthèse d'un ester, on introduit dans un ballon Vac=7,0 mL
d'acide méthanoïque et Val=10,0 mL d'éthanol. On introduit également
dans le ballon quelques grains de pierre ponce ainsi quelques gouutes
d'acide sulfurique concentré.
.4. Nommer les éléments du montage.
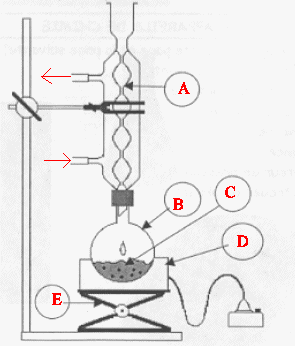
A : réfrigérant à eau ; B: ballon ; D
: chauffe ballon ; E : élévateur à
croisillons.
5. Nommer les groupes caractéristiques présents.
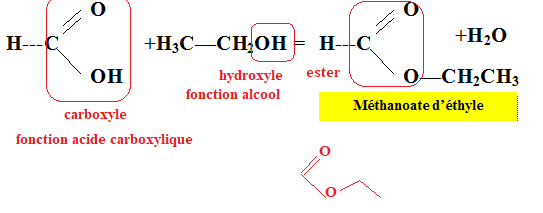
6. Représenter la formule topologique du formiate d'éthyle.
7. Citer deux avantage du chauffage à reflux et indiquer une précaution à respecter pour réaliser cette synthèse.
En travaillant à température modérée on accélère la réaction : la température est un facteur cinétique.
On évite les pertes de matière : les vapeurs se condensent dans le réfrigérant à eau et retombent dans le milieu réactionnel.
L'acide est corrosif et l'alcool et l'ester sont inflammables. Port de
blouse, gants, lunette et travailler loin de toute flamme.
8. Quel est le rôle de l'acide sulfurique ?
Catalyseur.
9. Calculer les quantités de matière des réactifs.
Masse volumique de l'acide méthanoïque : 1,22 g / mL.
Masse de cet acide :1,22 x 7,0 =8,54 g.
M(HCOOH) = 46 g / mol.
n =8,54 / 46 =0,1856 ~0,19 mol.
Masse volumique de l'éthanol : 0,79 g / mL.
Masse de cet alcool :0,79 x 10,,0 =7,0 g.
M(alcool) = 46 g / mol.
n =7,0 / 46 =0,152 ~0,15 mol.
0,15 mol d'alcool réagit avec 0,15 mol d'acide, celui-ci est en excès et l'alcool est en défaut.
10. Le rendement étant de 0,70, calculer la masse d'ester.
n(ester) =0,152 mol ; M(ester) =74,0 g / mol.
Masse théorique d'ester : 0,152 x 74,0 =11,25 g.
Masse réelle : 11,25 x0,70 =7,9 g.
Pour
améliorer le rendement sans changer la nature des réactifs, on aurait
pu utiliser le dispositif de distillation fractionnée.
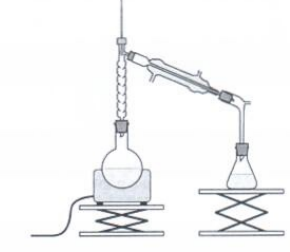
L'espèce la plus volatile ( température d'ébullition la plus faible Téb(ester) = 54°C) , l'ester distille en premier.
En éliminant l'un des produits au fur et à mesure qu'il se forme, on déplace l'équilibre dans le sens direct.
|
...
|
....
|
Le dosage par titrage. Burette de Mohr.
Solution S1 : chlorure de potassium K+aq + Cl-aq de concentration C1 et de volume V1 = 200,0 mL.
Solution S2 : nitrate d'argent Ag+aq + NO3-aq de concentration C2 =0,080 mol / L.
12. Identifier la solution titrante et la solution titrée. Quelle solution est dans la burette ?
Solution titrante : nitrate d'argent de concentration connue placée dans la burette.
Solution titrée : chlorure de potassium.
Réaction support du titrage : Ag+aq + Cl-aq --> AgCl(s).
L'équivalence est repérée par le changement de couleur de l'indicateur coloré, le chromate de potassium. V2E = 7,5 mL.
13 Définir l'équivalence et calculer C1.
A l'équivalence, les quantités de matière sont en quantités
stoechiométriques. Avant l'équivalence, l'ion chlorure est en excès,
après l'équivalence, l'ion argent est en excès.
V2E C2 = V1C1 ; C1 = 7,5 x 0,080 / 200=3,0 10-3 mol / L.
Il est possible de déterminer la concentration des ions chlorure par titrage conductimétrique.
14. Comment cette courbe permet-elle de trouver le volume à l'équivalence ?
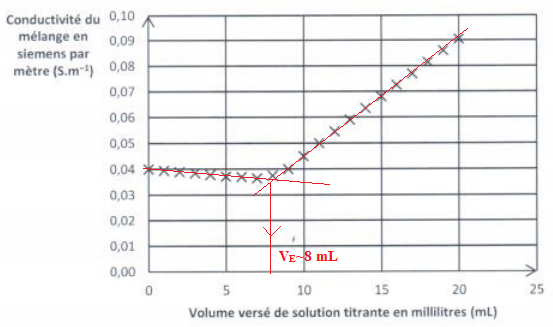
15 Justifier l'allure de la courbe.
Conductivité molaire ionique en mS m2 mol-1.
K+ : 7,3 ; Cl- : 7,6 ; Ag+ : 6,2 ; NO3- : 7,1.
Diminution de la conductance G avant l'équivalence.
L'ion
argent est en défaut avant l'équivalence ; du point de vue de la
conductivité, tout revient à remplacer l'ion chlorure par l'ion nitrate
de conductivité molaire ionique un peu plus faible.
La conductivité, et en conséquence la conductance de la solution diminue lentement.
Augmentation de la conductance G après l'équivalence.
L'ion
argent est en excès après l'équivalence. On ajoute des ions argent et
nitrate à la solution. La conductivité de la solution va croître assez
vite.
|
|



