Analyse
d'un sol,
bac général La Réunion
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| .. |
.
.
|
|
.
.
|
..
..
......
...
|
De nombreux éléments minéraux, tel le fer, et l’azote sont indispensables pour permettre aux
végétaux de synthétiser la chlorophylle. Si ces éléments sont déficitaires dans le sol, la
concentration en chlorophylle sera moindre et la couleur des végétaux moins verte. Ainsi,
lorsqu’un sol est en carence de fer, les feuilles se décolorent et deviennent jaunes : c’est ce qu’on
appelle la chlorose ferrique.
PARTIE A : Étude de la réaction mise en jeu.
En présence d’ions thiocyanate SCN
−(aq) incolores les ions fer (III) Fe
3+(aq) forment des ions
thiocyanatofer (III) [FeSCN]
2+(aq) colorés en solution aqueuse.
Données :
- Masse molaire du fer : M(Fe) = 55,8 g ⋅ mol
−1
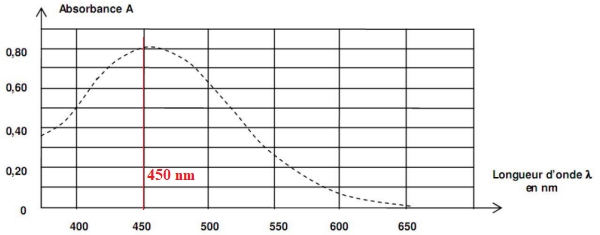
- Spectre d’absorption des ions thiocyanatofer (III) [FeSCN]
2+(aq) en solution aqueuse :
Équation de la réaction modélisant la transformation qui se produit lors du test de
détection :
Fe
3+(aq) + SCN
−(aq) = [FeSCN]
2+(aq)
- Constante d’équilibre K associée à cette réaction à 25°C : K = 130.
A.1. Déterminer, en justifiant, la couleur d’une solution contenant des ions thiocyanatofer (III)
[FeSCN]
2+(aq).
Le maximum d'absorption se situe vers 450 nm ( couleur violette). La
solution a la couleur complémentaire du violet soit le jaune.
On dissout une quantité de matière n1 = 1,0 × 10−3 mol d’ions fer (III) Fe
3+(aq) et une quantité
de matière n2 = 5,0 × 10−4 mol d’ions thiocyanate SCN
−(aq) dans un volume V = 500,0 mL d’eau.
A.2.1. Exprimer puis calculer le quotient réactionnel initial Qr,0.
Qr,0=[[FeSCN]
2+(aq)]0 / ([Fe
3+(aq)]0[SCN
−(aq)]0)=0
A.2.2. En déduire le sens d’évolution spontané de la transformation.
Qr0 < K, le système évolue dans le sens direct.
PARTIE B : Analyse d’un échantillon.
Les eaux qui ruissellent sur les sols et s’y infiltrent dissolvent les différents ions qu’ils contiennent.
Ainsi l’eau stockée dans les nappes phréatiques souterraines est caractéristique du sol traversé.
Afin d’évaluer la concentration en ions fer III contenus dans un sol, on dose par
spectrophotométrie les ions thiocyanatofer (III) [FeSCN]
2+(aq) contenus dans une solution
aqueuse S préparée comme suit :
- on introduit dans une fiole jaugée de 50,0 mL un volume V0 = 25,0 mL d’un échantillon
d’eau prélevé d’une nappe phréatique
- on y ajoute 1 mL d’une solution aqueuse d’acide chlorhydrique à 5 mol ⋅ L
−1
, puis 1 mL
d’une solution aqueuse de thiocyanate de potassium (K
+(aq), SCN
−(aq)) à 2 mol ⋅ L
−1
;
- on complète la fiole jusqu’au trait de jauge par de l’eau distillée.
B.1. Gamme d’étalonnage.
Cinq solutions étalon de différentes concentrations cf sont préparées à partir d’une solution
mère Sm en ions Fe(aq)
3+
de concentration cm= 2,0 × 10−3 mol ⋅ L
−1
.
Chacune de ces solutions, de volume total Vf = 50,0 mL, contient :
- un volume Vi de la solution mère Sm ;
- 1 mL d’une solution aqueuse d’acide chlorhydrique à 5 mol ⋅ L
−1
;
- 1 mL d’une solution aqueuse de thiocyanate de potassium (K
+(aq), SCN
−(aq)) à
2 mol ⋅ L
−1
;
- de l’eau distillée.
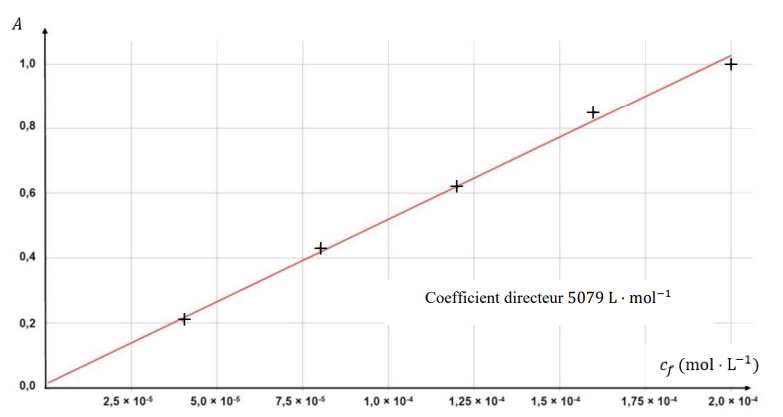
On mesure l’absorbance A pour chacune des solutions ci-après dans le tableau et on trace la
courbe d’étalonnage A = f(cf).
solution
|
1
|
2
|
3
|
4
|
5
|
cf (mol / L)
|
4,0 10-5
|
8,0 10-5 |
1,2 10-4
|
1,6 10-4
|
2,0 10-4
|
B.1.1. Préciser, en justifiant, la longueur d’onde à laquelle régler le spectrophotomètre pour
réaliser les mesures d’absorbance.
Pour une meilleure précision, on se place au maximum d'absorption ( 450 nm).
B.1.2. Dresser, en justifiant, la liste du matériel nécessaire à la réalisation de la solution étalon 5
à partir de la solution mère Sm.
Facteur de dilution = 2,0 10-3 / (2,0 10-4) = 10.
Fiole jaugée de 50,0 mL ; pipette jaugée de 5,0 mL; becher ; eau distillée.
B.1.3.1. Donner l’expression de la loi de Beer-Lambert en définissant chaque terme et en
donnant leur unité.
A = e L C.
A : absorbance ; e coefficient d'extinction molaire L mol-1 cm-1 ; l : largeur de la cuve en cm ; C concentration en mol / L.
B.1.3.2. Indiquer si cette loi est vérifiée dans le cas étudié.
le graphe est une droite passant par l'origine ; l'absorbance et la concentration sont proportionnelles. La loi est vérifiée.
B.2. Dosage de la solution S.
L’absorbance de l’échantillon S mesurée dans les mêmes conditions que pour les solutions
étalons est A = 0,70. Déterminer la masse d’ions Fe
3+(aq) contenue dans un litre d’eau de la nappe phréatique.
C = A / 5079 = 0,70 / 5079 ~1,378 10-4 mol / L.
Soit 1,378 10-4 x50 / 1000 =6,891 10-6 mol dans 50 mL de solution S.
6,891 10-6 mol dans 25 mL d'eau prélevée.
6,891 10-6 /0,025 =2,756 10-4 mol / L
M(Fe) =55,8 g/ mol.
Masse d'ion Fe3+aq dans 1 L d'eau : 2,756 10-4 x55,8 =1,54 10-2 g / L.
|