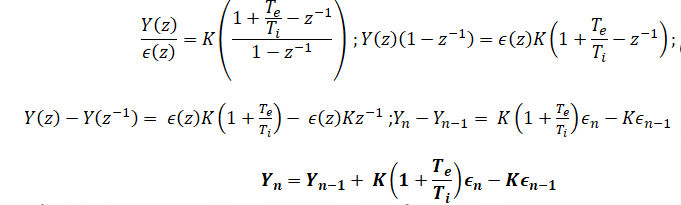L'oxydation de !'acétaldéhyde (ou éthanal) demeure la seconde voie la
plus importante de
synthèse de l'acide éthanoïque ou acide acétique, bien qu'elle ne soit
pas compétitive par
rapport à la carbonylation du méthanol.
À 70°C et 10 bar, en présence de différents ions métalliques, en
particulier de manganèse,
de cobalt et de chrome, qui jouent le rôle de catalyseur,
!'acétaldéhyde peut être oxydé par
le dioxygène de l'air pour produire de l'acide acétique. L'équation de
la réaction modélisant
la transformation chimique s'écrit :
CH
3CHO + ½0
2 --> CH
3COOH (a) .
Grâce aux catalyseurs, cette transformation chimique peut atteindre un
rendement de plus
de 95 %. Les principaux sous-produits sont l'acétate d'éthyle, l'acide
formique et le
formaldéhyde. Tous ces composés ont une température d'ébullition
inférieure à celle de
l'acide acétique et peuvent être facilement séparés par distillation.
La production totale d'acide acétique est estimée à 5 mégatonnes par
an, dont environ la
moitié vient des États-Unis. La production européenne se situe à
environ 1 mégatonne par
an et est en diminution. Enfin 0,7 mégatonne par an est fabriquée au
Japon. 1,5 mégatonne
par an est recyclée, ce qui situe le marché mondial à 6,5 mégatonnes
par an.
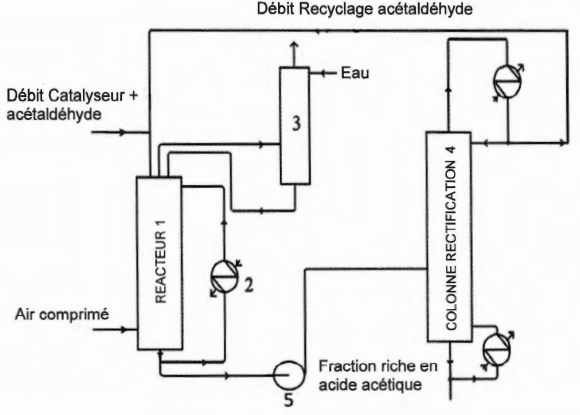
Le réacteur est une tour cylindrique fonctionnant sous une pression de 10 bar.
Au sommet de ce réacteur sont introduits à l'aide d'une rampe de pulvérisation :
!'acétaldéhyde recyclé provenant de la colonne de rectification (4), et le catalyseur (mis en
solution dans !'acétaldéhyde). Le réacteur est alimenté en air comprimé à contre-courant.
Les débits des réactifs sont maintenus constants.
La réaction étant exothermique. il faut évacuer l'énergie libérée. Pour cêla, une fraction du
milieu réactionnel circule au moyen d'une pompe centrifuge, au travers d'un échangeur (2)
alimenté en eau, la circulation des fluides s'effectuant à contre-courant.
Le débit du milieu réactionnel recyclé est constant et la température dans le réacteur est
régulée par le débit d'eau. Les gaz résiduaires sortant du réacteur, entraînant de faibles
quantités de produits et de réactifs, sont détendus et introduits dans une colonne de lavage
(3).
Les gaz sont lavés à l'eau avant d'être rejetés dans l'atmosphère. La solution récupérée en
pied de colonne est recyclée et renvoyée, à l'aide d'une pompe centrifuge, dans le réacteur.
Le milieu réactionnel est soutiré du réacteur (1) en fonction du niveau de liquide dans (1)
puis envoyé par la pompe (5) dans une colonne de rectification (4). Cette colonne fonctionne
sous pression. En tête, on récupère l'éthanal non converti qui est alors recyclé dans (1 ). En
pied, on obtient une fraction riche en acide acétique.
Partie A : étude préliminaire de la réaction mise en œuvre
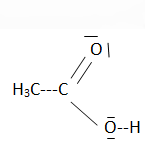
Q1 - Connaissant les numéros atomiques des atomes d'hydrogène Z(H) = 1, de carbone
Z(C) = 6 et d'oxygène Z(O) = 8, donner la structure électronique de chacun des atomes puis
proposer le schéma de Lewis de l'acide acétique.
H : 1 s
1 ; C : 1s
2 2s
2 2p
2 ; O :
1s2 2s2 2p4.
Q2 - Calculer l'enthalpie standard de la réaction (a)
d'oxydation de !'acétaldéhyde à 298 K et vérifier que cette réaction est exothermique.
D Hr=
D H°f(CH3COOH) -0,5 D H°f(O2)-D H°f(CH3CHO).
D Hr=(-436,4 -0 -(-191,7) = -244,7 kJ mol-1.
Cette enthalpie étant négative, la réaction est exothermique.
Q3 - Montrer que la réaction (a) d'oxydation de
!'acétaldéhyde peut être modélisée par deux demi-équations électroniques que l'on écrira.
Vérifier que cette réaction est favorisée.
CH
3CHO +H
2O--> CH
3COOH +2H
++2e
-. E° =-0,13 V.
½O
2 +2e
- +2H
+ --> H
2O. E° = 1,23 V.
La différence des potentiels redox étant de 1,36 V, la réaction est favorisée.
Partie B : étude de la circulation du milieu réactionnel entre le réacteur 1 et la
colonne 4
Données:
Accélération de la pesanteur : g = 9,8 m·s
-2
Masse volumique du milieu réactionnel: 850 kg ·m
-3
Masse volumique de l'eau : 1000 kg ·m
-3
.
La solution contenue dans le réacteur (1) est introduite dans la colonne de rectification (4)
à l'aide d'une pompe centrifuge (5). La pression absolue de fonctionnement de la colonne
est de 12 bar et on rappelle que la pression absolue en sortie de réacteur (1) vaut 10 bar.
La différence d'altitude entre la sortie du réacteur (1) et le niveau d'introduction de la solution
dans (4) est de 20 m.
Le diamètre de la tuyauterie entre (1) et (4) sera supposé constant et égal à 25 mm.
Les pertes de charge totales dans la canalisation entre (1) et (4) sont égales à 6,0 x 10
4 Pa.
Le débit massique d'introduction de la solution dans la colonne est égal à 588 kg·h
-1.
Q4 - Déterminer la valeur du débit volumique d'introduction de la solution dans la colonne,
exprimé en m
3·h
-1 et en m
3·s
-1.
Débit massique (kg h
-1)/ masse volumique (kg m
-3)=588 / 850 =0,692 m
3 h
-1.
q
v=0,692 / 3600 =1,92 10
-4 m
3 s
-1.
Q5 - En déduire, en m·s
-1 , la valeur de la vitesse de circulation de la solution lors de son
introduction dans la colonne.
Section S = 3,14 D
2 / 4 =3,14 x(25 10
-3)
2 / 4 =4,91 10
-4 m
2.
vitesse (m /s) = Débit volumique (m
3/s) / section (m
2)=1,92 10
-4 /(4,91 10
-4) =0,39 m /s.
Q6 - En appliquant le théorème de Bernoulli entre la sortie du réacteur (1) et l'entrée dans
la colonne (4), exprimer la hauteur manométrique totale de la pompe (HMT). Vérifier que la
valeur de la hauteur manométrique totale de la pompe est 51 mCL.
A : sortie de réacteur 1 ; B : introduction en (4).
(½rvB2 +PB +rgzB)-(½
rv
A2 +P
A +
rgz
A)
= Dp + P / qv.
La section de la tuyauterie étant constante, vA = vB.
zA =0 ; zB = 20 m.
PB +rgzB- PA= Dp + P / qv.
12 105 -10 105+850 x9,8 x20= -6 104 + P / qv.
4,27 105 Pa ou 4,27 bar= 42,7 mCE (mètre de colonne d'eau).
ou 42,7 / 0,850 =50 mCL.(mètre de colonne liquide )
Q7 - Calculer la puissance absorbée par la pompe. Les étapes du raisonnement effectué
seront détaillées précisément.
P = 4,27 10
5 x
1,92 10-4 =81,6 W.
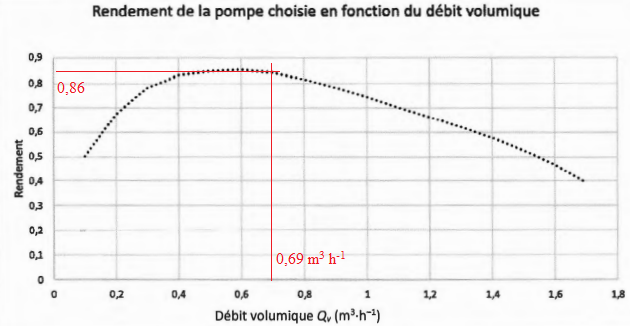
Puissance / rendement = 81,6 / 0,86 ~95 W.
Q8 - En justifiant la réponse, indiquer la pompe la plus adaptée.
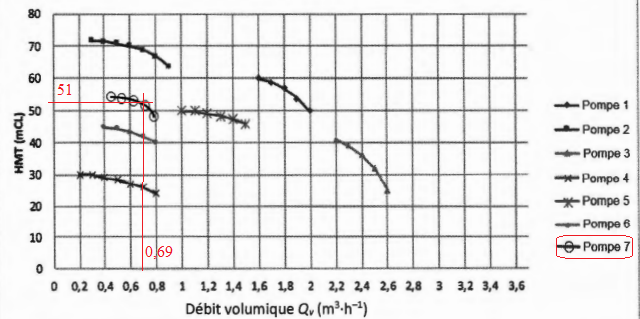 Partie C : analyse du produit synthétisé
Partie C : analyse du produit synthétisé.
La fraction riche en acide acétique obtenue en pied de colonne de distillation est une solution
aqueuse titrant environ 80 % en masse en acide, de masse volumique 1,07 kg-L
-1.
Elle peut être commercialisée ainsi ou purifiée pour obtenir de l'acide acétique possédant
un titre massique égal à 99,8 %.
Afin de vérifier la valeur du titre massique en acide de la fraction récupérée un technicien
effectue les opérations suivantes et obtient les résultats ci-desous.
Le certificat d'analyse délivré à l'issue de ces opérations stipule que la solution sera
commercialisable sous l'appellation « acide acétique 80 % » si le pourcentage massique en
acide est compris entre 78 et 82 %.
Il incombe au candidat de passer le temps nécessaire à l'élaboration de la réponse à
la question suivante. La qualité de rédaction, la structuration de l'argumentation et la
rigueur des calculs sont valorisées ainsi que les prises d'initiatives même si elles
n'aboutissent pas. Il convient donc que celles-ci apparaissent sur la copie.
Q9 - Indiquer si la solution récupérée à l'issue du
procédé est commercialisable sous l'appellation « acide acétique 80 % ».
-
Protocole d'analyse.
- Diluer d'un facteur 100 la solution d'acide acétique isolée en pied de colonne.
- Prélever 10,0 ml de cette solution diluée et les introduire dans un bécher.
- Rincer et remplir une burette avec une solution aqueuse d'hydroxyde de sodium
(Na
+(aq) + HO
-(aq)) de concentration 0, 100 mol·L
-1.
- Introduire la sonde de mesure du pH-mètre étalonnée dans le bécher et procéder au
titrage, sous agitation.
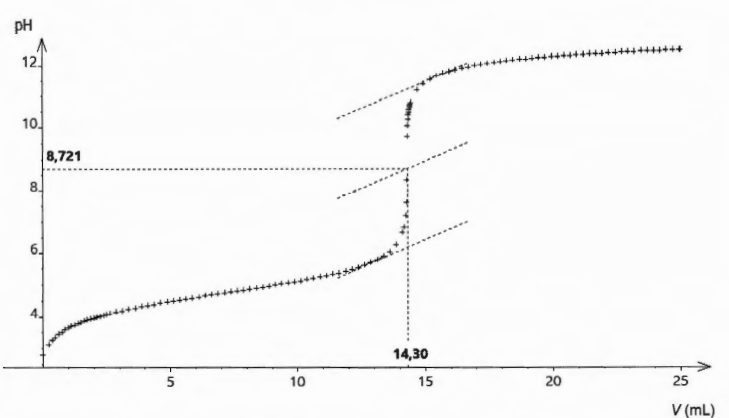
n(CH
3COOH) = 14,30 x 0,100 = 1,43 mmol dans 10,0mL.
Concentration = 1,43 / 10,0 = 0,143 mol / L.
Tenir compte de la dilution : 100 x0,143 = 14,3 mol / L.
Concentration massique : 14,3 x M(acide acétique) = 14,3 x 60 = 858 g / L.
Masse volumique de la solution : 1,07 kg / L.
Titre massique : 0,858 / 1,07 ~0,80. ( 80 %).
L'appellation " acide acétique 80 %" est valide.