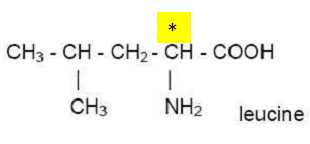
Partie A : La leucine
1. On nomme cette molécule acide 2-amino-4-méthylpentannoïque. Donner sa formule semi-développée.
 2
2 : Donner sa masse molaire moléculaire.
M(C
6H
13N O
2)=6 x 12 + 13 +14 +2 x16=131 g / mol.
3. Nommer les deux groupes fonctionnels.
NH2 : amino ; COOH : carboxyle.
4 : Les acides
a aminés, à une exeption près, sont des molécules chirales.
a. Justifier.
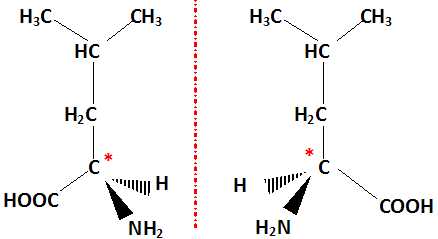
Présence d'un atome de carbone asymétrique repéré par *.
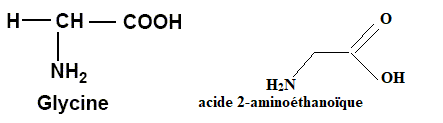
b. Quel est l'exception ? Ecrire sa formule topologique et donner son nom.
 5.
5. Représenter selon la convention de Cram les énantiomères de la leucine.
6. Définir un mélange racémique.
Mélange équimolaire des deux énantiomères.
Partie B.
On souhaite préparer 200 mL de solution tampon de pH = 10 à base de
leucine, ayant une concentration initiale en leucine de 1,0 mol / L. On
dispose de leucine cristallisée, d'une solution d'acide chlorhydrique
et d'une solution de soude.
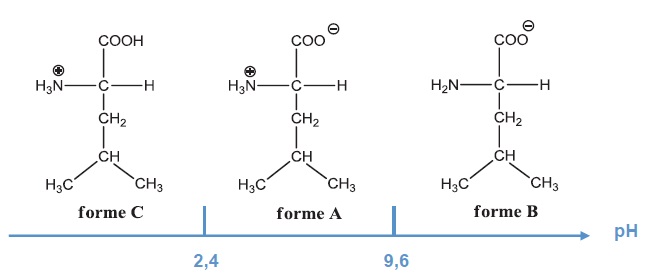
1. Ecrire la
formule semi-développée de l'espèce majoritaire de la leucine dans les
3 cas suivants pH = 1,8 ; pH = 7,2 ; pH = 11. On donne pKa1 = 2,4 ;
pKa2 = 9,6.
2. Quelle masse de leucine faut-il peser ?
n = 0,20 mol ; m = M(leucine) x n = 131 x 0,20 =26,2 g.
3. On dissout cette masse dans 150 mL d'eau distillée. Le pH est 6.
a. On veut ajuster le pH à 10. Doit-on ajouter de la soude ou de l'acide chlorhydrique ?
Ajouter une base, la soude.
b. Ecrire l'équation de la réaction qui se produit lors de cet ajout.
(CH3)2-CH2-CH(NH3+)-COO- aq+HO-aq-->(CH3)2-CH2-CH(NH2)-COO- aq+H2O(l).
c. Expliquer pourquoi la solution est qualifiée de tampon.
pH est proche de pKa2. Les deux formes du couple acide / base sont pratiquement dans les mêmes proportions.