Chimie,
concours
Police Technique et Scientifique 2022.
( zone Nord)
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Pour
chaque question, cocher ou entourer la (ou les) réponse(s) correcte(s)
Question
1 : Quel composé suivant est le 2-méthylbutane.
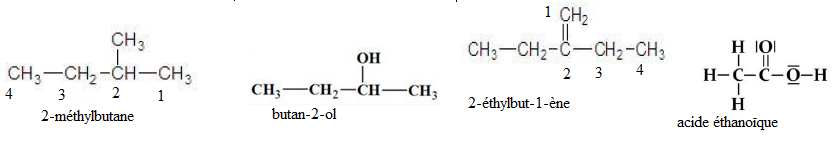 Question 2
Question 2 : La molécule dont la formule semi-développée est donnée ci-dessous :
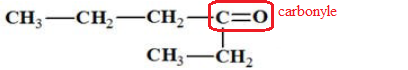
A est un aldehyde vrai ; B. est une cétone ; C. possède un groupe carboxyle ;
D. est un alcool primaire.
Question 3 :Un atome de silicium possède 14 électrons. Sa configuration électronique s'écrit
A. 1s2 2s2 2p6 3s2 3p2
vrai ; B.1s2 2s2 3s2 2p6 3p2 ; C. 1s2 1p6 2s22p4 ; D. 1s2 2p6 2s2 2p4.
Question 4 : L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène. Elle est utilisée pour décolorer les
cheveux. Le schéma de Lewis du peroxyde d'hydrogène H2O2 peut être :
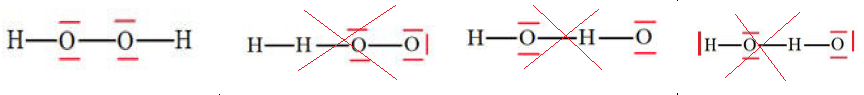
Question
5 : La réaction mettant en jeu les couples :
Aℓ3+ (aq) / Aℓ (s) et Zn2+ (aq) / Zn (s) peut s'écrire :
A : Zn2+ (aq) + Aℓ (s) → Zn (s) + Aℓ3+ (aq)
B : 3 Zn2+ (aq) + 2 Aℓ (s) → 3 Zn (s) + 2 Aℓ3+ (aq) vrai
C : Zn2+ (aq) + Aℓ3+ (aq) → Zn (s) + Aℓ (s)
D : 3 Zn (s) + 2 Aℓ3+ (aq) →Zn2+ (aq) + Aℓ3+ (aq
Question 6 :
Dans la réaction suivante Ce4+ + Fe2+--> Ce3+ + Fe3+.
A. Ce4+ est un oxydant vrai ; Ce4+ est un réducteur ; C. Fe2+ est un oxydant; D. Fe2+ est un réducteur vrai.
Ce4+ + e- = Ce3+ ; Ce4+ gagne un électron, c'est un oxydant qui se réduit.
Fe2+--> e- + Fe3+. Fe2+ cède un électron, c'est un réducteur qui s'oxyde.
Question 7 : Deux isotopes ont :
A. le même numéro atomique vrai ; B. le même nombre de masse ; C. le même nombre de protons vrai ;
D. le même nombre de neutrons
Question 8. Parmi les instruments suivants lequel permet de mesurer l’acidité d’une solution
A. spectrophotomètre
; B. conductimètre
; C.pHmètre vrai ; D. ohmètre. .
Question 9 : Le pH d'une solution d'hydroxyde de sodium dans laquelle [HO- ]=2,5 10-3 mol/L est égal à ::
A. 11,6 ; B. 12,4 ; C.12,6; D. 11,4. Vrai
[H3O+] = 10-14 / (2,5 10-3) = 4 10-12 mol / L; pH = - log (410-12) =11,4
Question 10. Laquelle de ces molécules représente-t-elle un alcène ?
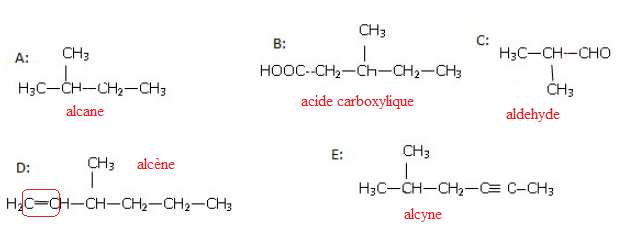
|
...
|
....
|
Question 11 : Dans la molécule d’ammoniac NH3 , le type VSEPR de l'atome central d’azote est:
AX3E 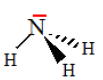 réponse A. réponse A.
Question 12 :Pour préparer 100 mL d'une solution de concentration molaire 0,100 mol . L–1 en maltose, la quantité de matière de maltose à dissoudre est égale à :
A.10,0 mol ; B. 1,00 mol ; C. 0,010 mol vrai; D.0,001 mol.
Question 13 :L'ion hydrogénosulfate HSO4− (aq) appartient au(x) couple(s) acide-base suivant(s) :
A : HSO4− (aq) / H2SO4 (ℓ)
B : H2SO4 (ℓ) / HSO4− (aq) vrai
C : HSO4− (aq) / SO42− (aq) vrai
D : SO42− (aq) / H3SO4−.
Question 14 : Quelle est la concentration des ions HO- dans une solution aqueuse avec pH = 8,2 ?
[H3O+] =10-8,2 =6,3 10-9 mol / L.
[HO- ] = 10-14 / (6,3 10-9 )=1,58 10-6 mol / L. réponse C.
Question 15 :Lors de la dissolution du glucose dans l'eau :
A : la solution obtenue est un corps pur.
B : l'eau est le solvant. Vrai
C : le glucose est le soluté. Vrai.
Question 16 : Dans l'équation chimique :
2 CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (ℓ)
A : CH4 (g) est un réactif vrai
B : H2O (ℓ) est un produit vrai
C : O2 (g) est un produit
Exercice 1.
Un individu est appréhendé suite à une agression à l'aide d'un produit
corrosif. La victime présente de sévères lésions cutanées. Le
comportement de l'agresseur laisse penser qu'il est sous l'effet de
l’alcool. Sur les lieux des faits est retrouvée une bouteille ouverte
contenant un liquide inconnu. Les enquêteurs trouvent par ailleurs un
sachet de cannabis dans les poches de l'agresseur. Enfin ce dernier est
soumis à un examen médical.
I. Analyse du liquide inconnu : (7,5 points)
1. Quels produits
peuvent provoquer des lésions cutanées ? A quelles grandes familles
chimiques appartiennent-ils ? Donner des exemples.
Acides forts et bases fortes concentrées ; acide de Lewis; eau oxygénée concentrée, hydrures métalliques.
2. La mesure du pH indique une valeur inférieure à 1. Conclure.
Il s'agit d'une solution d'acide fort concentrée.
3. L'ajout de quelques gouttes d'une solution aqueuse de AgNO3 provoque l'apparition d'un précipité blanc qui noircit à la lumière. Faire la synthèse de ces informations.
Acide chlorhydrique H3O+ + Cl-.
4. Écrire la réaction de formation du précipité.
Cl-aq + Ag+aq --> AgCl (s).
5. On procède à un
dosage afin de titrer le liquide inconnu. On dilue ce liquide 100 fois
afin de procéder au dosage. On prélève 10 mL de la solution obtenue que
l’on dose par une solution (B) décimolaire de NaOH.
La courbe correspondant à ce dosage est représentée ci-dessous.
a- Faire un schéma annoté du montage utilisé pour le titrage.
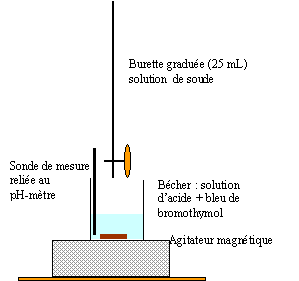
b- Quelles sont les règles de sécurité à respecter lors de la dilution et dosage ?
port de blouse, gants et lunettes.
c- Définir l’équivalence.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques.
6. Comment détermine-t-on le volume à l’équivalence :
a-Lors d’un dosage colorimétrique ? changement de couleur.
b -Lors d’un dosage pH-métrique ? Important saut de pH.
7. En expliquant votre méthode, déterminé graphiquement le pH d'équivalence.
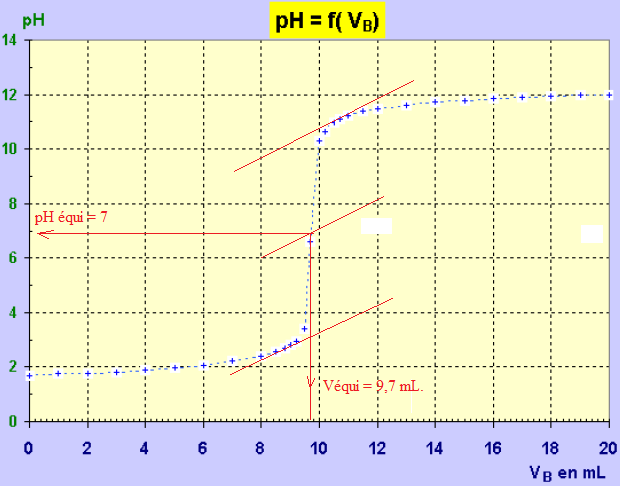
8. Parmi les
indicateurs colorés acido-basiques proposés dans le tableau ci-après,
quel est celui qui est le mieux adapté au titrage précédent? Justifier.
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré. ( bleu de bromothymol; rouge de phénol )
9. - Calculer la concentration molaire du liquide inconnu.
CaVa = Cb Véqui ; Ca = Cb Véqui / Va = 0,10 x 9,7 / 10 =0,097 mol / L.
Tenir compte de la dilution : 100 x 0,097 = 9,7 mol / L.
II Analyse toxicologique : (7,25 points)
L'analyse des prélèvements biologiques de l'agresseur permet de mettre en évidence la présence d'alcool dans le sang.
Le dosage est effectué par chromatographie en phase gazeuse.
1. Quel est le rôle de la chromatographie ? Donner des exemples de techniques chromatographiques.
Identifier, séparer, doser les espèces d'un mélange.
Chromatoghraphie par adsorption, chromatographie de partage
liquide-liquide ; chromatographie sur couche mince ( CCM),
chromatographie par échange d'ion, chromatographie en phase gazeuse
(CPG), chromatographie liquide haute performance ( HPLC).
2. La
chromatographie est couramment utilisée à des fins quantitatives pour
déterminer la concentration des composés cibles dans un échantillon.
Afin que cela soit possible, il est nécessaire de préparer une courbe d'étalonnage : représentation graphique de
la relation entre le facteur de réponse (axe X) qui est généralement la
surface ou la hauteur du pic chromatographique et la concentration de
l'analyte (axe Y).
- Tracer la courbe d'étalonnage.
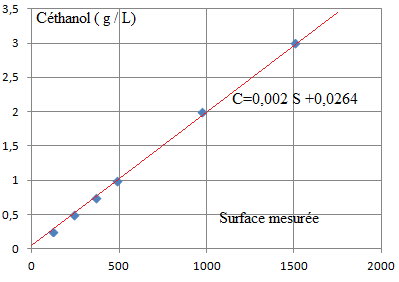
3. L'analyse effectuée sur le sang donne les résultats suivants (deux mesures)
S1=1239 ; S2 = 1251.
A l'aide de la droite de calibration précédemment établie, estimer l'alcoolémie du mis en cause.
En prenant en compte que cette analyse est basée sur le fait que l'aire des pics chromatographiques est
proportionnelle à la concentration ou à la quantité de produit analysé.
C1 = 0,002 * 1239 +0,0264 =2,50 g / L
C2 = 0,002 * 1251 +0,0264 =2,53 g / L.
4. Détection du cannabis dans l’organisme.
Lors
du contrôle, les enquêteurs ont procédé à un test salivaire sur
l’individu afin de dépister son éventuelle consommation de cannabis.
Si le résultat est positif, il doit ensuite être confirmé par une analyse de sang.
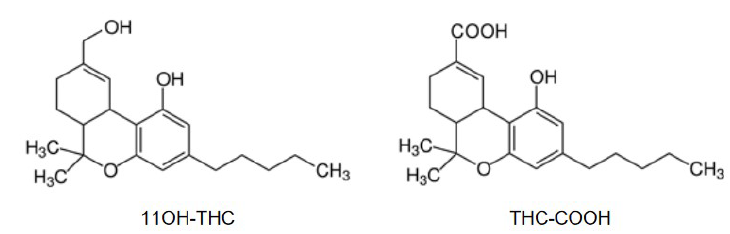
La substance active du cannabis est le THC (ou tétrahydrocannabinol) de formule donnée ci-dessous.
Lors de la consommation de cannabis, l’organisme stocke du THC,
notamment dans les graisses, le sang et les cheveux. La formule brute
du THC est C21H30O2.
Dans l’organisme, le THC est progressivement dégradé essentiellement en
deux composés, le 11OH-THC et le THCCOOH, dont les formules sont:
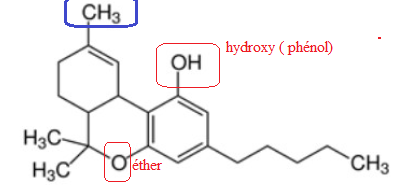
a. Sur la formule du THC, entourer les groupes fonctionnels présents dans la molécule et les nommer.
b. Sur cette même
formule , encadrer et nommer le groupe d’atomes qui subit une
transformation lors de la dégradation du THC dans l’organisme.
c. En déduire, en justifiant, les formules brutes du 11OH-THC et du THC-COOH.
11OH-THC : oxydation de CH3 du THC en CH2OH : C21H30O3.
THC-COOH : oxydation de CH3 du THC en COOH : C21H28O4.
|
|