Chimie,
Synthèse de la Migrastatine, concours G2E ( Géologie, Eau,
Environnement
)2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
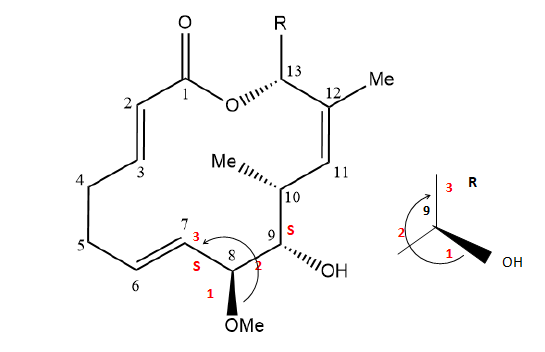
La migrastatine 1 est une macrolactone (un macrocycle contenant une
fonction ester). La migrastatine a montré un pouvoir inhibiteur sur la
migration des cellules cancéreuses et joue donc un rôle important lors
des processus de chimiothérapie. Des recherches ont été développées sur
les analogues de la migrastatine, notamment l’analogue 2, qui présente
un pouvoir plus important contre les cellules cancéreuses.
23. Donner la configuration absolue des atomes de carbone asymétriques numéro 8 et numéro 9 du composé 1. Justifier.
Une des synthèses développées de l’analogue 2 a été élaborée à partir
du furfural. Le furfural réagit avec le composé 3 pour conduire au
composé 4 selon la réaction suivante :
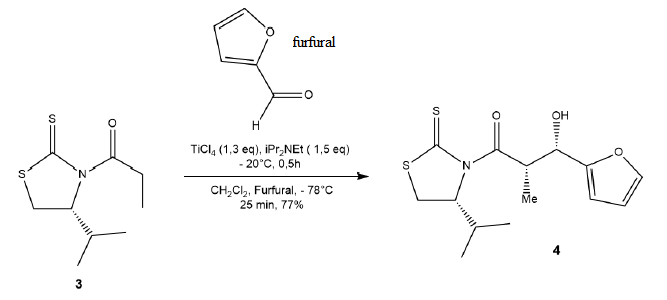
Le diisopropyléthylamine iPr2NEt est utilisée en tant que base non nucléophile.
24. Nommer la réaction permettant la transformation du composé 3 en composé 4.
Aldolisation.
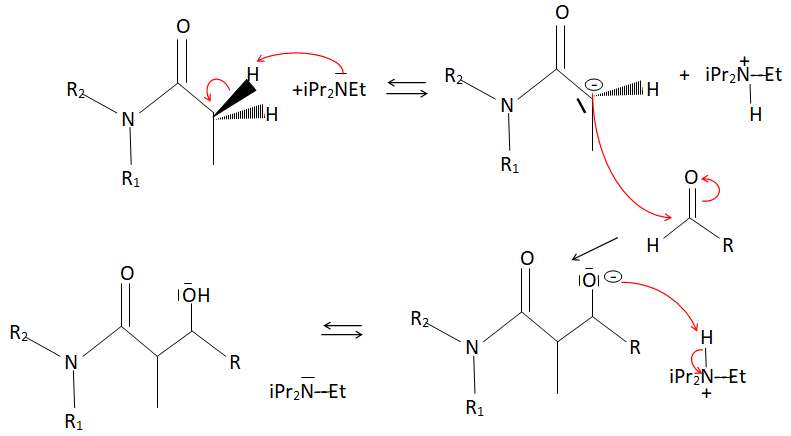
25. Écrire le mécanisme correspondant au passage du composé 3 au composé 4. On ne se
préoccupera pas ici de l’intervention de TiCl4 dans le mécanisme, ni des considérations stéréochimiques. Les notations des molécules pourront être simplifiées.
Le DIBAL-H, hydrure de diisobutylaluminium, est un donneur d’hydrure.
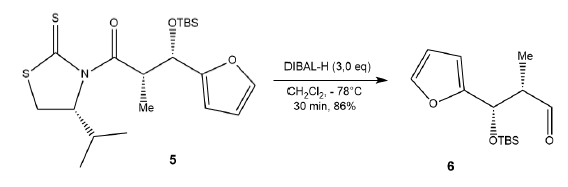
26. Caractériser la transformation du composé 5 en composé 6 parmi les termes suivants :
substitution, réaction acide-base, oxydation, réduction, addition, élimination.
Le nombre d'oxydation du carbone passe de +III dans l'amide cyclique à +I dans l'aldehyde.
On donne ci-dessous les signaux obtenus en spectroscopie RMN du proton lors de l’analyse du composé 6.
Signal
|
d (ppm)
|
Intégration
|
Multiplicité
|
A
|
9,82
|
1H
|
doublet
|
B
|
5,10
|
1 H
|
doublet
|
C
|
2,83 - 2,70
|
1 H
|
multiplet
|
D
|
1,10
|
3 H
|
doublet
|
E
|
7,34
|
1 H
|
doublet
|
F
|
6,31
|
1 H
|
doublet de doublet
|
G
|
6,21
|
1 H
|
doublet
|
H
|
0,90
|
9 H
|
singulet
|
I
|
0,05
|
3 H
|
singulet
|
J
|
0,03
|
3 H
|
singulet
|
27. Attribuer
les signaux A à D aux protons correspondants du composé 6. Les signaux
E, F, G correspondent aux protons portés par le cycle et ne seront pas
attribués. Les signaux H, I, J correspondent aux protons portés par le
groupement -TBS et ne seront pas attribués.
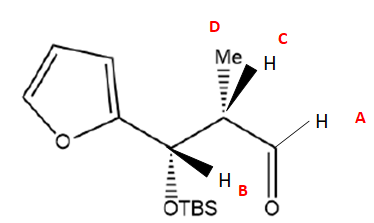
28. Expliquer la multiplicité observée des protons
B couple avec l'unique proton C C : donc doublet.
C couple avec trois groupes de protons différents ( A, B et D) : donc multiplet.
D. les trois protons équivalents couplent avec l'unique proton C : donc doulet.
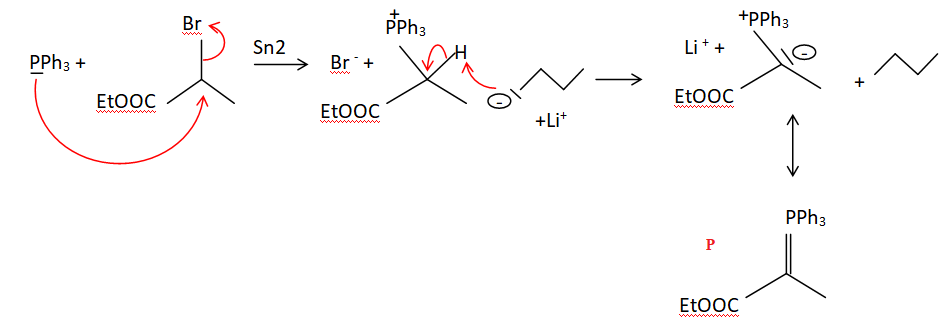
29.
Le passage du composé 6 au composé 7 se fait en ajoutant du
2-bromopropanoate d’éthyle, du buthyllithium et de la
triphénylphosphine. Écrire les équations des réactions se produisant
entre ces trois derniers composés. Proposer des mécanismes réactionnels
et nommer le réactif phosphoré (noté P) obtenu.
Un mécanisme Sn1 conduit à un carbocation instable du fait de la proximité du groupe -COOEt électroattracteur.
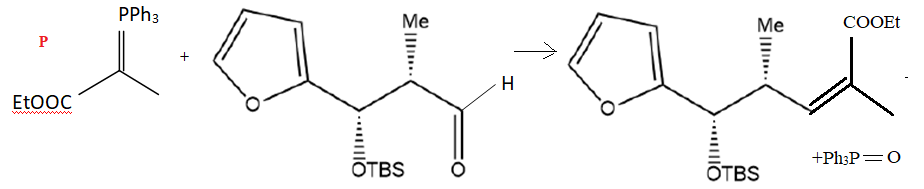
30. Écrire l’équation de la réaction entre le composé P et le composé 6. Nommer la réaction réalisée.
Réaction de Wittig.
|
|