Chimie
analytique.
Concours technicien police technique et scientifique 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Degré alcoolique d'une boisson.
On additionne V = 100 mL d'une solution de vin à une solution contenant de l'acide sulfurique concentré et un excès de K2Cr2O7 ( 0,10 g).
1. Ecrire la réaction qui se produit entre le dichromate de potassium et l'éthanol. Calculer sa constante d'équilibre.
3 fois {
C2H5OH +H2O = CH3COOH + 4H+ + 4e-
} oxydation alcool
E1 =0,035 +0,06 / 12 log([CH3COOH]3 [H+]12/ [C2H5OH]3 ).
2 fois {
Cr2O72-
+ 14H+
+ 6e- = 2Cr3+
+ 7 H2O
} réduction de
l'ion dichromate.
E2 = 1,333 +0,06 / 12 log([Cr2O72-]2[H+]28/ [Cr3+]4 ).
3C2H5OH + 2Cr2O72-
+16H+= 3CH3COOH
+ 4Cr3+ + 11 H2O.
K = [CH3COOH]3 [Cr3+]4 / ([C2H5OH]3[Cr2O72-]2[H+]16).
E1=E2 =0,035 +0,06 / 12 log([CH3COOH]3 [H+]12/ [C2H5OH]3 ) = 1,333 +0,06 / 12 log([Cr2O72-]2[H+]28/ [Cr3+]4 ).
1,333 -0,35 =0,06 / 12 log (K) ; log (K) = 196,6 ; K ~10196.
K étant très grand, la réaction est totale.
2. Quelle est l'inégalité entre les quantités de matière initiales de Cr2O72- notée n1,0 et de C2H5OH notée n2 0 ?
n1,0 / 2 > n2 0 / 3.
3. Etablir la relation liant n1 0, la quantité de matière restante d'ion dichromate notée n1 et le degré alcoolique d ( pourcentage volumique d'éthanol dans le vin).
Volume d'éthanol dans le vin : Vd / 100= 100 d / 100 mL =10-3 d litre.
Masse d'éthanol : 10-3 d x masse volumique éthanol =7,91 10-4 d g.
Quantité de matière d'éthanol : 7,91 10-4 d / M(éthanol) =7,91 10-4 d / 46 =1,72 10-5 d mol.
Quantité de matière d'ion dichromate nécessaire au titrage : 2 / 3 x 1,72 10-5 d =1,14 10-5 d mol.
Quantité de matière initiale d'ion dichromate : n1,0=0,10 / M( dichromate) =0,10 / 294 = 3,4 10-4 mol.
n1,0- n1 =1,14 10-5 d.
4. Après
réaction complète de l'éthanol, un volume de 0,1 L d'iodure de
potassium de concentration 1 mol / L est additionnée au mélange
précédent. Les ions iodures sont en excès. Ecrire la réaction qui
se produit et calculer sa constante d'équilibre.
Cr2O72-
+ 14H+
+ 6e- = 2Cr3+
+ 7 H2O
}
3 fois { 2I- = I2 + 2e- }
E3 = 0,53 +0,06 / 6 log([ I2]3 / [I-]6).
Cr2O72-
+ 14H+
+ 6I- = 2Cr3+
+3 I2 + 7 H2O.
E2 = 1,333 +0,06 / 6 log([Cr2O72-] [H+]14/ [Cr3+]2 ).
K = [Cr3+]2 [ I2]3 / ([Cr2O72- ][H+]14 [I-]6).
0,53 +0,06 / 6 log([ I2]3 / [I-]6) =1,333 +0,06 / 6 log([Cr2O72-] [H+]14/ [Cr3+]2 ).
1,333 -0,53 = 0,06 / 6 log( K) ; K ~1080. Réaction totale.
5. Il se forme n3 = 0,56 mmol de diiode. Calculer d.
Quantité de matière d'ion dichromate en excès : n1 = n3 / 3 = 0,56 / 3 =0,187 mmol = 1,87 10-4 mol.
n1,0- n1 =1,14 10-5 d.
3,4 10-4 -1,87 10-4 =1,14 10-5 d ; d =13,4°..
Recherche et dosage de l'éthanol dans le sang total par Headspace-GC-FID.
Préparation de l'échantillon.
1. Expliquer le principe de l'injection de l'espace de tête en amont de la chromatographie en phase gazeuse.
2. Donner deux autres modes d'injection.
Les injecteurs peuvent fonctionner suivant deux modes, avec ou sans division (encore appelés split ou splitless).
En
mode split, le gaz vecteur pénètre avec un grand débit dans la chambre
de vaporisation ; une vanne de fuite sépare le courant gazeux en deux
parties : seule la plus petite pénétre dans la colonne. Ce
mode est utilisé dans les colonnes capillaires à faible débit. Le mode
splitless est utilisé dans le cas d'échantillons très dilués.
3.
Pour la préparation de l'échantillon sanguin, une solution d'étalon
interne ( tertiobutanol ) est ajoutée quantitativement à la prise
d'essai ainsi qu'un aliquot de solution de chlorure de sodium. Quelle
est son rôle ?
4. Que signifie le pictogramme suivant ?

Inflammable.
5. Donner la formule semi-développée du tertiobutanol.
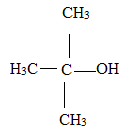
6. Donner deux autres noms chimiques du tertiobutanol.
alcool ter-butylique ; triméthylcarbinol ; butanol tertiaire.
Séparation chromatographique et détection FID.
7. Rappeler brièvement le principe de la chromatographie gazeuse.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic
8. Citer deux avantages à l'utilisation du dihydrogène en tant que gaz vecteur dans une séparation chromatograpique gazeuse.
Vitesse plus élévée, température de four inférieure.
9. Quel est le critère d'identification de l'éthanol avec une détection par ionisation de flamme ?
Le temps de rétention.
10. Expliquer en quoi consiste la méthode de l'étalonnage interne.
Cette technique permet de s'affranchir complètement des volumes injectés.
Elle
est relativement longue à mettre en oeuvre. L'étalon interne n'est pas
facile à trouver : il doit avoir une structure chimique proche des
solutés analysés, ne pas interférer avec les solutés, ne pas réagir
chimiquement avec d'autres constituants présents et doit être
compatible avec le système de détection.
Le pic de l'étalon interne sert d'échelle.
11. Citer deux autres méthodes d'étalonnage.
Etalonnage par ajouts dosés ; étalonnage externe.
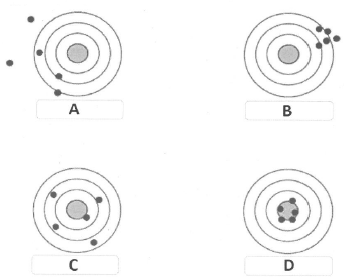
12. Indiquer le terme adapté à chacune des cibles.
pas juste mais fidèle B; juste et fidèle D; juste mais pas fidèle C ; ni juste ni fidèle A.
Boire ou conduire.
Un homme boit 66 cL d'une bière forte. Il est autorisé à conduire si la teneur d'alcool dans le sang est inférieure à 0,5 g / L.
Phase 1 : passage de l'alcool à travers la paroi stomacale dans le sang.
C2H5OH estomac --> C2H5OH sang .
L'estomac est considéré comme un milieu réactionnel de volume V1.
Un homme boit 250 mL d'un apéritif contenant 1 mole d'éthanol. On note C1 = C0-x, la concentration de l'éthanol dans le sang en fonction du temps. C0 est la concentration initiale.
t en min
|
0
|
1,73
|
2,8
|
5,5
|
18
|
22
|
C1(mol / L)
|
4,0
|
3,0
|
2,5
|
1,6
|
0,2
|
0,1
|
C1/C0.
|
1
|
0,75
|
0,625
|
0,4
|
0,05
|
0,025
|
-ln(C1/C0)
|
xxxx
|
0,29
|
0,47
|
0,92
|
3,0
|
3,7
|
k1 = -ln(C1/C0) / t (min-1)
|
xxx
|
0,17
|
0,17
|
0,17
|
0,17
|
0,17
|
1. Que représente x ?
L'avancement volumique ( mol / L).
2. Le
sang et les autres liquides contenus dans le corps seront considérés
comme un milieu réactionnel unique, dénomé "sang" de volume V2 = 40 L constant. Calculer C2 de l'alcool dans le "sang" à t = 18 min dans le cas où aucune oxydation de l'éthanol ne s'est pas produite.
0,2 mol /L dans un volume de 0,25 L soit 0,05 mol d'éthanol.
0,05 / 40 = 1,25 10-3 mol / L.
Un homme boit 360 mL d'un apéritif contenant 1 mole d'éthanol. On note C1 = C0-x, la concentration de l'éthanol dans le sang en fonction du temps. C0 est la concentration initiale.
t en min
|
0
|
120
|
240
|
360
|
480
|
600
|
C2(mol / L)
|
0,05
|
0,0413
|
0,0326
|
0,0239
|
0,0152
|
0,0065
|
3. Tracer C2 en fonction du temps.
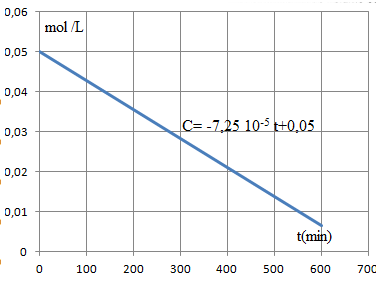
4. Au bout de combien de temps toute trace d'alcool a t-elle disparu ?
t = 0,05 / (7,25 10-5) ~690 min.
5. Calculer la concentration maximale en mol / L tolérée en France de l'alcool dans le sang.
0,5 g / L soit 0,5 / M(éthanol) =0,5 / 46 ~1,1 10 -2 mol / L.
On peut montrer que C 2 = C 0 V 1/V 2 ( 1-exp(-k 1t))-k 2t.
En buvant ses 2 bières à 8 % notre homme absorbe 66 cL et 0,9 mol d'alcool.
6.a. Déterminer l'instant t max pour lequel la concentration en éthanol est maximale dans le sang.
V1 = 0,66 L ; C0 = 0,9 / 0,66 =1,36 mol / L ; V2 = 40 L.
k2 = 7,25 10-5 mol L-1 min-1 ; k1 = 0,17 min-1.
On dérive C 2 par rapport au temps et on annule la dérivée :
k1C0 V1/ V2 exp(-k1tmax))-k2=0 ; exp(-k1tmax)) =k2V2 /(k1C0 V1)=7,25 10-5 x 40 /(0,17 x1,36 x0,66)=3,2 10-3.
-k1tmax = ln(0,032) =-3,44 ; tmax =3,44 / 0,17 ~ 20 min.
6.b. Calculer cette concentration. Peut-il conduire ?
C2 = C0 V1/V2 ( 1-exp(-k1t))-k2t = 1,36 x0,66 / 40(1- exp(-0,17 x20))-7,25 10-5 x20 =0,022 (1-exp(-3,4))-1,45 10-3 ~0,02 mol / L.
Il ne peut donc pas conduire.
6.c. Au delà de tmax la courbe s'apparente à une droite. Expliquer pourquoi.
A t > tmax le terme en exponentielle est négligeable devant 1.
|
...
|
....
|
Chromatographie liquide.
1. Ecrire la formule brute de l'acétate d'ammonium et de l'acide formique.
CH3 COO- + NH4+ ; HCOOH.
2. Calculer leur masse molaire.
M(C2H7NO2) =24+7+14+32=77 g/mol ; M(CH2O2)=46 g/mol.
3.
Calculer le volume à prélever d'acide formique et la masse à peser
d'acétate d'ammonium pour préparer 0,5 L d'une phase mobile
composée de 0,1 % d'acide formique et de 5 mM d'acétate d'ammonium.
m(C2H7NO2) = 5 10-3 x77 =0,385 g.
0,5 x 1 10-3 =5 10-4 L = 0,5 mL.
4. Le coefficient de partage log P est une mesure de la solubilité différentielle d'un composé chimique entre deux solvants.
P = C' / C avec C' : concentration du composé dans l'octanol et C : concentration du composé dans l'eau.
Si C' > C : P > 1 ; le composé est lipophile.
Si C' < C : P < 1 ; log P <0 ; le composé est hydrophile.
5. Le log P de la morphine est compris entre 0,8 et 0,9 et celui de la cocaïne entre 1,9 et 2,3.
Quel composé sera le plus retenu sur une colonne de chromatographie liquide en phase inverse de type C18 ?
La colonne est peu polaire et hydrophobe. La cocaïne, plus lipophile que la morphine sera le plus retenu.
6. Comment peut-on déterminer le temps mort d'une séparation en chromatographie liquide expérimentalement ?
La mesure du temps mort s'effectue en injectant un produit non retenu par la colonne.
Spectrométrie de masse.
7. Quelles sont les 3 parties d'un spectrographe de masse ?
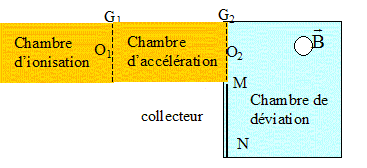 Dans
la chambre d'ionisation sous l'effet d'un bombardement électronique,
l'acide crotonique est fragmenté, ionsé en cations de charge q = +e. On
s'intéresse ici à deux de ces ions de masses respectives m1 et m2. En O1 la vitesse de es ions est négligeable.
Dans
la chambre d'ionisation sous l'effet d'un bombardement électronique,
l'acide crotonique est fragmenté, ionsé en cations de charge q = +e. On
s'intéresse ici à deux de ces ions de masses respectives m1 et m2. En O1 la vitesse de es ions est négligeable.
Les ions sont accélérés entre O1 et O2 sous l'action d'un champ électrique uniforme E créé par une différence de potentiel U = VG1-VG2.
Dans la chambre de déviation, ces ions sont déviés par un champ
magnétique uniforme de direction perpendiculaire au plan de la figure
et venant vers nous. Un collecteur d'ions est constitué d'une plaque
photosensible entre M et N.
Les chambres sont sous vide. On négligera le poids devant les autres forces.
8. La source d'ionisation Electrospray est-elle douce ou dure ?
Source d'ionisation douce.
9. Que signifie l'acronyme MRM ?
Multiple Reaction Monitoring.
10. Citer deux autres modes d'acquisition possibles avec un QqQ.
Piège à ions 3D ou linéaire (LIT) , analyseurs haute résolution.
11. Que repporte t-on en abscisse et en ordonnées dans un spectre de masse ?
Abscisse : rapport m / z ; ordonnées : abondance relative des ions détecté ( 100 pour le plus abondant).
12. L'adduit formé
en souce électrospray de la cocaïne ( ion parent) est un adduit
hydrogène. Que voit-on sur le spectre de masse en mode scan ?
13. Citez un autre
type d'analyseur en spectrographie de masse pouvant être utilisé en
couplage avec la chromatographie liquide.
Electrospray et APCI
Démarche qualité.
14. Que signifie NF dans la norme NF-EN-ISO n°170025 v17 ?
Norme française.
15. Que signifie v17 dans la norme NF-EN-ISO n°170025 v17 ?
Année 2017.
16. Est-ce qu'il y a une différence entre accréditation et certiification pour un laboratoire ?
Accrédditation : confirmation et reconnaissance de la compétence professionnelle par un organisme tiers.
La certification confirme que certaines exigences pour les processus, les produits ou les services sont respectées.
17. Au sein d'un laboratoire, l'amélioration continue peut se faire par :
Analyse des indicateurs du laboratoire.
Questionnaires de satisfaction envoyés aux clients.Vrai.
Les audits internes et externes. Vrai.
QCM couplage LC-MS.
1. Parmi les interactions moléculaires suivantes, laquelle nintervient pas en chromatographie liquide :
ionique, polaire, covalente ( faux), hydrophobe.
2. En chromatographie liquide en phase inverse, quelle proposition est correcte ?
La phase stationnaire polaire et la phase éluante apolaire.
La phase stationnaire apolaire et la phase éluante polaire. Vrai.
3. Lequel de ces solvants est le plus éluant en chromatographie liquide en phase inverse ?
eau ; acétonitrile, méthanol.
couple eau acétonitrile.
4.
Un composé acide a un pKa de 4,2. Quel pH sera optimal pour le retenir
sur une colonne de chromatographie liquide en silice greffée C18 ?
pH > 6,2 ( composé sous la forme apolaire AH)
5. Si la longueur de la colonne est doublée, quel est l'impact sur la pression en tête de colonne ?
La pression de tête de colonne est à peu près proportionnelle à la longueur de la colonne.
6. Une température de source d'ionisation à pression atmosphérique élevée augmente le signal.
7. Pour préparer une solution tampon aqueuse en couplage LC-MS on peut utiliser :
du monohydrogénophosphate de sodium.
du chlorure de sodium
de l'acétate d'ammonium.
8. Lequel de ces tampons est à proscrire pour une analyse en couplage LC-MS en électrospray positif :
acide formique ; ammoniaque ; acétate de sodium ; acide acétique.
9. Cinq analyses identiques sont réalisées à des jours différents.
Cette série permet de déterminer :
la reproductibilité, la
répétabilité, la précision intermédiaire.
10. Laquelle de ces propositions est juste ?
Si une relation est linéaire, alors le coefficient de régression R2 est proche de 1.
Si le coefficient de régression R2 est proche de 1, alors une relation est linéaire. Vrai.
|
|




