|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
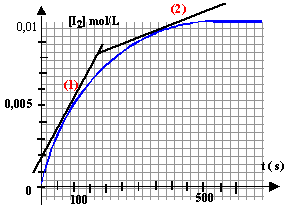
Cette transformation totale est modélisée par la réaction d'équation : H2O2 + 2I- +2H3O+ --> I2 + 4H2O A la date t = 0, on ajoute une solution acidifiée d'iodure de potassium (K+ ; I-) à une solution d'eau oxygénée ; les ions iodure et les ions oxonium sont en excès. On obtient la courbe ci-dessous donnant l'évolution de la concentration [I2] (le diiode est la seule espèce colorée) en fonction du temps. 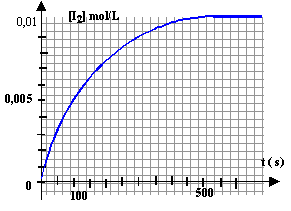
état final : K+ ; I- ; 2H3O+ ; H2O ; I2 ; H2O2 étant en défaut est entierement consommée. On peut suivre l'évolution de la cinétique par spectrophotométrie : le diiode est la seule espèce colorée ; aux faibles concentrations, l'absorbance A et la concentration [I2] sont proportionnelles. K+ est spectateur, sa concentration ne varie pas H2O2 ; I- ; H3O+ sont des réactifs : leurs concentrations diminuent au cours du temps. I2 est un produit ; sa concentration augmente au cours du temps.
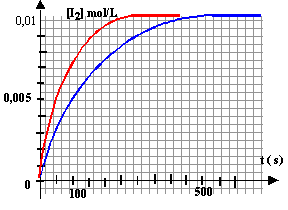
La vitesse est donnée par le coefficient directeur de la tangente à la courbe, à la date considérée. (1) tangente très inclinée sur l'horizontale : coefficient directeur important (2) tangente peu inclinée sur l'horizontale : coefficient directeur faible la vitesse de la réaction diminue au cours du temps car les concentrations des réactifs diminuent. A une température plus élevée, la vitesse est plus rapide et on atteint plus rapidement l'état final ( courbe rouge).
|
||||||||||||||||||||||
|
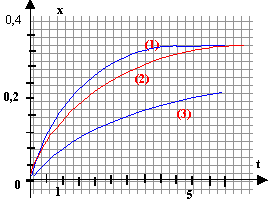
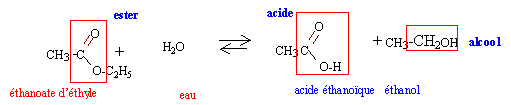
Les graphes représentent l'avancement x d'une transformation au cours du temps, lorsqu'on fait réagir 1 mol d'éthanoate d'éthyle et 1 mol d'eau ; les conditions expérimentales varient.
unités des grandeurs représentées : x avancement en mol ; t durée en heures courbe 1 : expérience C : q=80°C, 2 mL acide sulfurique concentré : précence d'un catalyseur et température la plus élevée courbe 2 : expérience B : q=50°C, 2 mL acide sulfurique concentré : température plus faible et présence d'un catalyseur courbe 3 : expérience A : q=50°C, sans catalyseur facteurs cinétiques mis en jeu : catalyseur et température. La vitesse est donnée par le coefficient directeur de la tangente à la courbe, à la date considérée. La vitesse de la réaction diminue au cours du temps car les concentrations des réactifs diminuent. caractéristiques de cette hydrolyse : lente, limitée par l'estérification Le montage à reflux permet de réaliser l'expérience C.
|
|||||||||||||||||||||||
|
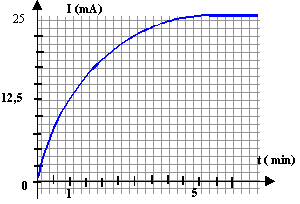
En présence d'eau, le 2-chloro-2-méthylpropane (CH3)3C-Cl subit une transformation qui conduit à la formation d'un alcool. Cette transformation est totale mais relativement lente. Qtés de matière initiales : n1 = 3 mmol de 2-chloro-2-méthylpropane et 100 mL d'eau en excès.
corrigé
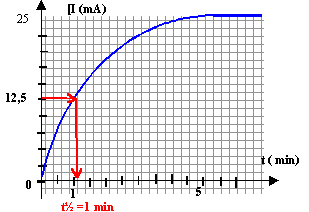
Les ions chlorure Cl- et oxonium H3O+ rendent la solution conductrice. L'intensité I du courant est proportionnelle à la concentration des ions chlorure [Cl-] : [Cl-] = k I avec k une constante, I en ampère, [Cl-] en mol m-3. au delà de 5 minutes la réaction est terminée : [Cl-] = 3 10-3 / 100 10-6 = 30 mol m-3 et I= 0,025 A d'où k = 30 / 0,025 = 1200 mol m-3 A-1.
Pour faire diminuer ce temps de demi réaction on peut travailler à température plus élevée et utiliser un catalyseur. concentration finale [Cl-]max des ions chlorure dans le mélange réactionnel : Qté de matière d'ion chlorure en mol / volume de la solution en L = 3 10-3 / 100 10-3 = 0,03 mol / L. |
|||||||||||||||||||||||
|
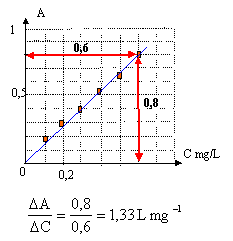
On réalise une échelle de teintes à partir de solutions de concentrations massiques connues en ions fer III. Ces ions complexés par les ions thiocyanates donnent à la solution une teinte rouge. On mesure l'absorbance A de chaque solution par spectrophotométrie. 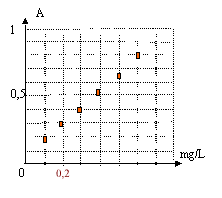 On mesure l'absorbance Avin d'un échantillon de vin blanc par la même méthode : Avin = 0,45.
corrigé Dosage par étalonnage, on compare l'échantillon à doser à une série d'échantillons étalons. La méthode de dosage nécessite de préparer une échelle de teintes, c'est à dire un ensemble de solutions étalons ( de concentrations connues) ; puis on compare la teinte de la solution dont on veut déterminer la concentration, aux teintes des solutions étalons..
Concentration massique en ion fer III de l'échantillon de vin : Avin = 0,45. A = 1,33 C soit Cvin = A/1,33 = 0,45 / 1,33 =0,34 mg /L. Dilution de la solution mère : le facteur de dilution vaut : concentration solution mère / concentration solution fille = 10 / 2 = 5. le volume de la pipette sera : volume fiole jaugée / facteur de dilution = 50 / 5 = 10 mL prélever 10 mL de solution mère à l'aide d'une pipette graduée placer dans la fiole jaugée de 50 mL et compléter àvec de l'eau distillée jusqu'au trait de jauge, puis agiter. spectrophotomètre : Rechercher d'abord la longueur d'onde l pour laquelle la solution présente le maximum d'absorption. Les mesures d'absorbances seront faites à cette longueur d'onde. Mesurer d'abord l'absorbance du solvant, l'eau dans ce cas, puis l'absorbances des solutions étalons. |
|||||||||||||||||||||||
|
|