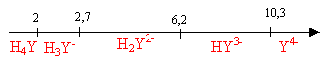|
cinétique
d'une réaction de complexation Antilles 03
On se propose d'étudier la réaction de complexation des
ions chrome (III) par l'EDTA, en solution aqueuse maintenue à pH =
5,1.Constante de dissociation de l’ion complexe [CrY]- : KD = 1,0 .
10-23
Constante de formation de l’ion complexe [CrY]- : β = 1,0 . 1023
a) Donnez l’expression de la constante de dissociation ou de la
constante de formation
du complexe [CrY]-.
Données (à 25 °C) :
L'EDTA est introduit sous forme de sel disodique Na2H2Y
qui se dissocie totalement en ions Na+ et H2Y2-
en solution.
· pKa de l'EDTA, H4Y, en solution aqueuse :
pKa1 (H4Y/H3Y-) =
2,0 ; pKa2 (H3Y-/H2Y2-)
= 2,7 ; pKa3 (H2Y2-/HY3-) =
6,2 ; pKa4 (HY3-/Y4-) = 10,3
· Constante de dissociation de l'ion complexe [CrY]-
: KD = 1,0 10-23.
- Etude des équilibres acido-basiques.
- Sur une échelle de pH, indiquer les domaines de prédominance des
espèces acido-basiques de l'EDTA en fonction du pH. Préciser l'espèce
prédominante à pH = 5,1.
- Donner les expressions des constantes Ka3 et Ka4.
- Exprimer la concentration [Y4-] en solution en fonction
des constantes d'acidité Ka3, Ka4, de la
concentration en H3O+ et de la concentration [H2Y2-].
- En admettant que la concentration [H2Y2-] est
constante, égale à 0,100 mol.L-1, calculer la valeur
numérique de la concentration [Y4-] en solution à pH = 5,1.
- Etude de la réaction de complexation : dans la solution
contenant l'ion H2Y2- à la concentration de 0,100
mol.L-1, maintenue à pH = 5,1, on introduit des ions Cr3+
à raison de 3,0 10-3 mol.L-1. On admettra que la
concentration [Y4-] reste constante, égale à 5,0 10-8
mol.L-1, tout au long de la réaction de complexation.
- Donner l'expression de la constante de dissociation du complexe [CrY]-.
- Montrer que la réaction de complexation est pratiquement totale, en
calculant la concentration des ions Cr3+ à l'équilibre.
- Etude cinétique de la réaction de complexation : dans cette
question, l'équation de la réaction est écrite sous la forme : Cr3+
+ H2Y2- = [CrY]- + 2 H+ .
La réaction est totale ; elle est d'ordre partiel 1 par rapport aux
ions Cr3+ et d'ordre partiel 1 par rapport à H2Y2-
La constante de vitesse est notée k.
La solution contient initialement C0 = [Cr3+]0
= 3,10-3 mol.L-1 d'ions Cr3+ et [H2Y2-
]0 = 0,100 mol.L-1 d' ions H2Y2-.
On suit le déroulement de la réaction, à température, volume et pH
constants, de façon à déterminer la concentration en ions Cr3+
non complexés (notée C) en fonction du temps écoulé t :
|
t (min)
|
0
|
10
|
20
|
30
|
40
|
60
|
90
|
120
|
|
C (mol.L-1)
|
3 10-3
|
2,7610-3
|
2,55 10-3
|
2,35 10-3
|
2,16 10-3
|
1,83 10-3
|
1,43 10-3
|
1,12 10-3
|
- Donner l'expression de la vitesse de la réaction en fonction de k,
constante de vitesse, et des concentrations [H2Y2-]
et [Cr3+].
- Montrer que la concentration [H2Y2-] peut être
considérée comme constante. Donner alors une expression simplifiée de
la vitesse de réaction, en introduisant une constante k' égale à k[H2Y2-]0.
- Vérifier que la loi cinétique est alors du type: log(C0/C)
= k't par une méthode graphique.
- Donner la valeur de k'. Préciser son unité.
corrigé
à pH=5,1 , H2Y2- prédomine.
Ka3 associé à l'équilibre acide base H2Y2-+
H2O=HY3-+ H3O+ : Ka3
= [HY3-][H3O+] / [H2Y2-]
(1)
Ka4 associé à l'équilibre acide base HY3- +
H2O=Y4-+ H3O+ : Ka4
= [Y4-][H3O+] / [HY3-] (2)
(1) donne : [HY3-] =Ka3[H2Y2-]
/ [H3O+]
(2) donne : [Y4-] =Ka4[HY3-]/
[H3O+] = Ka4Ka3[H2Y2-]
/([H3O+])²
[H2Y2-] = 0,1 ; [H3O+]
= 10-5,1 = 7,94 10-6 mol/L ; Ka4= 10-10,3
=5 10-11 ; Ka3= 10-6,2 =6,3 10-7
;
[Y4-] = 6,3 10-7 *5 10-11
*0,1 / (7,94 10-6)²= 5 10-8
mol/L.
[CrY]- = Y4- + Cr3+
constante associée KD =[Cr3+][Y4-]
/ [[CrY]-] = 10-23
[Y4-] =5,0 10-8 mol/L ; [Cr3+]*5,0
10-8 / [[CrY]-] = 10-23
; [Cr3+] / [[CrY]-] =10-23
/ (5 10-8 )= 2 10-16.
[[CrY]-] =[Cr3+] /2 10-16 = 5
1015 [Cr3+]
conservation de l'élément chrome : [Cr3+] + [[CrY]-]
= 3 10-3 =[Cr3+] + 5 1015 [Cr3+]
= 3 10-3;
[Cr3+] = 6 10-19
mol/L
donc la réaction de complexation est totale ( pratiquement
tous les ions chrome (III) ont disparu de la solution)
vitesse de formation du complexe v= k [H2Y2-]
[Cr3+].
H2Y2-est en large excès devant Cr3+
; [H2Y2-] peut être considérée comme une
constante égale à [H2Y2-]0
par suite v = k [H2Y2-]0 [Cr3+]
= k'[Cr3+]
|
t (min)
|
0
|
10
|
20
|
30
|
40
|
60
|
90
|
120
|
|
C (mol.L-1)
|
C0 =3 10-3
|
2,7610-3
|
2,55 10-3
|
2,35 10-3
|
2,16 10-3
|
1,83 10-3
|
1,43 10-3
|
1,12 10-3
|
|
C0/C
|
1
|
1,086
|
1,176
|
1,277
|
1,39
|
1,64
|
2,10
|
2,68
|
|
log(C0/C)
|
0
|
0,036
|
0,07
|
0,106
|
0,142
|
0,215
|
0,32
|
0,43
|
|
log(C0/C)/t
|
xxxxxx
|
3,6 10-3
|
3,5 10-3
|
3,53 10-3
|
3,55 10-3
|
3,58 10-3
|
3,55 10-3
|
3,56 10-3
|
k'= 3,55 10-3 min-1.
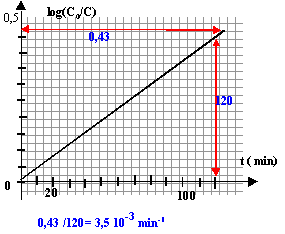
la courbe est une droite, donc la loi log(C0/C) =
k't est bien vérifiée
|