|
d'après BTS domotique 2003 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||
| .
. |
||
|
||
|
|
L'installation schématisée ci-dessous comporte un compresseur, un détendeur et deux serpentins qui sont siège des échanges thermiques. 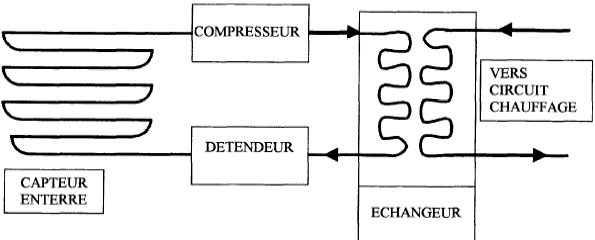 La température du sous sol est 10°C. Le fluide caloporteur est de l'air assimilé à un gaz parfait. On étudie les transformations réversibles d'1 kg d'air décrivant le cycle suivant : 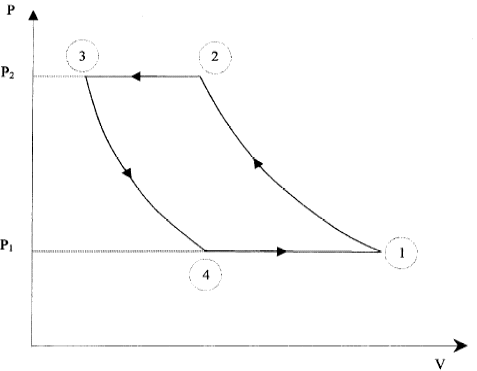 1-2 : dans le compresseur, la compression est adiabatique et la pression passe de P1= 4 105 Pa à P2 = 15 105 Pa. La température passe de T1=283 K à T2. 2-3 : Dans le serpentin, au contact du circuit de chauffage, le refroidissement est isobare et la température passe de T2 à T3=323 K. 3-4 : Dans le détendeur, la détente est adiabatique, la pression passant de P3=P2 à P4=P1, la température passant de T3 à T4. 4-1 : Dans le serpentin enterré dans le sol, le réchauffement est isobare, la température augmentant jusqu'à la température T1. lors d'une transformation adiabatique réversible : PVg=Cte ; P1-g Tg=Cte ; Vg-1T=Cte. Qté de chaleur échangée par un fluide passant de la température T1 à T2 au cours d'une transformation isobare : Q=mCp(T2-T1). Efficacité théorique d'une machine théorique : e= |Qc/W| ou e= |Qf/W| selon la machine R= 8,31 J K-1mol-1 ; g= 1,4 Cp air = 1000 J K-1kg-1.
corrigé P11-g T1g=P21-g T2g soit T2g = (P1/P2)1-g T1g T2 = (P1/P2)(1-g) /g T1 avec (1-g) /g = (1-1,4)/1,4=-0,286. T2 = (4/15)-0,286 *283 = 1,454*283 = 413 K. de même T4 = (P3/P4)(1-g) /g T3= (P2/P1)(1-g) /g T3 T4 = (15/4)-0,286 *323 = 0,6852*323 = 221 K. quantités de chaleur Q12, Q23, Q34 et Q41 échangées par une masse d'air de 1 kg isobare Q23 = mCp(T3-T2) = 1000*(323-413)= -90 kJ. isobare Q41 = mCp(T1-T4) = 1000*(283-221)= 62 kJ. adiabatique Q12 = Q34 = 0. Au cours d'un cycle la variation d'énergie interne du gaz est nulle. W+ Q23 + Q41 =0 soit W = 90-62 = +28 kJ. efficacité théorique de la pompe à chaleur au cours du cycle = rapport de la chaleur absorbée par la source chaude sur le travail fourni e = 90 / 28 = 3,21. énergie à fournir pour compenser les pertes journalières : 13*24 = 312 kWh = 312*3600=1,12 106 kJ travail fourni par le moteur électrique de la pompe : 312 /3,21 = 97,2 kWh le moteur doit fonctionner pendant : 97,2 /10 = 9,72 heures.
|
|
|
Un capteur électronique permet d'obtenir une tension u1 = 0,1 q3 dans laquelle q3 est la température de l'échangeur exprimée en °C tendis que la tension u1 est exprimée en volts. Le but de la régulation est de maintenir cette température q3 entre 45°C et 55 °C. On utilise le montage suivant : 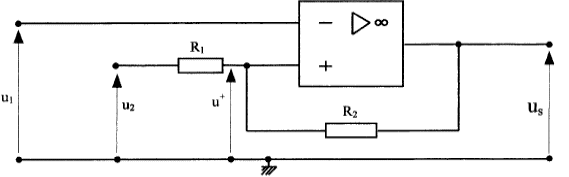 L'amplificateur opérationnel est idéal ; les tensions de saturation sont +14V et -14 V. R1 = 1 kW et R2 = 27 kW. u2 est une source de tension réglable dont la valeur est fixée à 5,19 V.
corrigé 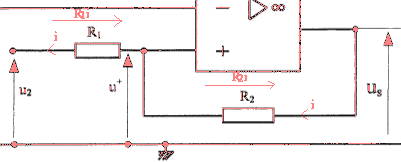
u2+R1i=u+ soit i = (u+ -u2)/R1 u+ +R2i =us soit i = ( us-u+)/R2 (u+ -u2)R2=( us-u+)R1 R2u+-u2R2=usR1-u+R1 u+=1/(R1 +R2) [R1us+R2u2] si us = +14 V alors u+= 5,5 V et us = -14 V alors u+= 4,5 V la température de l'échangeur est 20°C. valeur impossible pour us qui ne peut être inférieure à -14 V. A la mise sous tension la pompe à chaleur se met en marche q3 évolue de 20°C à 55°C et u1évolue de 2 V à 5,5 V. us atteint alors la valeur +14 V et doit couper l'alimentation électrique de la pompe. La température q3 se met alors à chuter. Dès que u1 atteint la valeur 4,5 V ( us= -14 V) la pompe se remet en marche.La température de l'échangeur vaut alors 45°C.
|
||
|
Chimie : on se propose de déterminer l'alcanalité d'une eau industrielle. Pour ceci on réalise un dosage pH-métrique de 50 mL d'eau par une solution d'acide chlorhydrique telle que [H3O+]=0,1 mol/L. L'alcanalité est due uniquement à l'ion HCO3-. 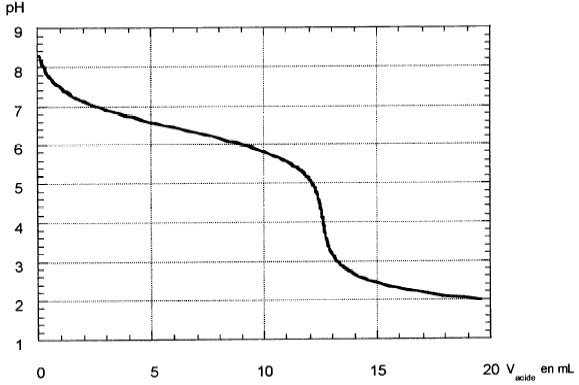
masse atomique molaire (g/mol) H : 1 ; C : 12 ; O : 16. couples acide base H3O+ / H2O ; H2O / HO- ; H2O , CO2/HCO3- corrigé 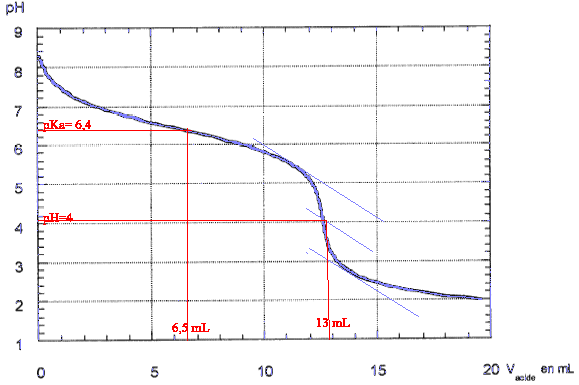
HCO3- + H3O+ = CO2 + 2H2O à l'équivalence CaVa= CbVb soit Cb= CaVa /Vb = 0,1*13/50=0,026 mol/L masse molaire HCO3- : 1+12+3*16 =61 g/mol 0,026*61 = 1,586 g/L pour doser 100 mL de cette eau avec un acide de concentration 0,02 mol/L il faudrait un volume d'acide égal à : 100*0,026/0,02 = 130 mL.
|
||
|
|
