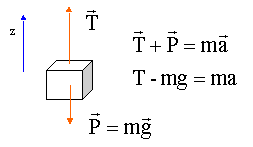|
d'après concours masso-kinésithérapie ADERF En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
|
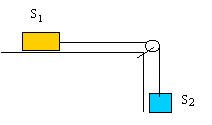
corrigé Origine des temps et des distances : lacher de S1. L'axe vertical est orienté vers le bas. distance parcourue par S1 : d1 = ½gt² = 4,9 t². 0,2 m sont parcourus en : t²= 0,2/4,9 = 0,0408 soit t = 0,2s. distance parcourue par S2 : d2 = ½g(t-0,2)² +0,4 lors de la rencontre les solides ont parcouru la même distance ,d1 = d2 . 4,9 t² =4,9(t-0,2)² +0,4 4,9 t² = 4,9
t²-1,96 t + 0,196 +0,4 soit t = 0,3 s
T=m(g+a) =
1000(9,8+2)=11
800 N.
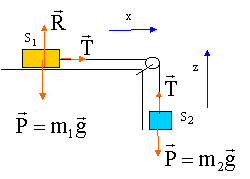
les deux solides ont la même accélération et les tensions sont identiques. écrire la seconde loi de Newton : pour S1 suivant l'axe x : T=m1a pour S2 suivant l'axe z : T-m2g=m2a m1a -m2g
= m2a d'où a = m2g / (m1+m2)
(période en seconde, distance en mètre, masse en kg) Msoleil = 4p²r3/ (GT²) T ²= (365,25*24*3600)² = 9,96 1014 . Msoleil
=4*3,14²*(1,51011)3 / (6,67 10-11*9,96
1014)= 2
1030 kg.
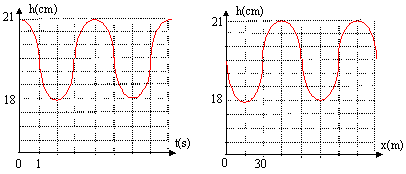
T= 6,28 (0,12/42)½ = 0,336s. premier passage à la position d'équilibre ( de droite vers la gauche) : 0,336/4 = 0,084 s. premier passage à la position d'équilibre ( de la gauche vers la droite) : 0,75*0,336 = 0,247 s. puis 0,084 + 0,336 = 0,42 s ; 0,084+2*0,336 = 0,756s ; 0,084+3*0,0336 = 1,092 s. et 0,247 +0,336 =
0,583 s ; 0,247 +2* 0,336 = 0,919 s.
déterminer la force motrice à partir de la puissance : F= P /v = 60 000/36,11 = 1661,5 N d'après le principe d'inertie, la voiture est pseudoisolée donc la force motrice compense les frottements kv² = F soit k = 1661,5 / 36,11² = 1,27 N m-2 s2 ( ou kg m s-2 m-2 s2 soit kg m-1)
|
|||||||||||||||||||||||||||||||||||
dou l'intensité I= 8 1010 / 220 = 3,64 108 A intensité moyenne
par ménage : 3,64 108 / 3 107 = 12,1 A.
Q= C U= 10-6 *10 = 10-5 C énergie initalement stockée par le condensateur : ½Q²/C0= 0,5* 10-10 / 10-6 = 5 10-5 J. énergie finale en stock : ½Q²/C1= 0,5 10-10 / 0,2 10-6 = 2,5 10-4 J. variation
d'énergie = énergie fournie au condensateur = 2 10-4 J.
échange d'énergie entre bobine et condensateur : la bobine peut stockée au maximum ½LI²max d'où L= 2* 3,6 10-4 / 0,2² = 0,018 H = 18 mH.
|
||||||||||||||||||||||||||||||||||||
corrigé longueur d'onde l= c/f =340 / 533 = 0,64 m Les points M distants d'un nombre entier de longueur d'onde sont en phase avec le haut-parleur. 0,64 m ; 1,28 m
et 1,92 m soit 3 points.
célérité =l / T = 60 / 4 = 15 m/s.
f = cair /l air = 3 108 / l air . pour le bleu : 3 108 / 400 10-9 = 7,5 1014 Hz. pour le rouge : 3
108 / 800 10-9 = 3,75 1014 Hz.
diviser par 1,6 10-19 pour obtenir une énergie en électronvolt : 2,55 eV énergie de l'atome au niveau n=2 : E2 = -13,6 / 2² = -3,4 eV l'atome gagne 2,55 eV, son énergie finale devient : -3,4+2,55= -0,85 eV -0,85 = -13,6 / n² donne n²= 13,6 / 0,85 = 16 et n= 4.
|
||||||||||||||||||||||||||||||||||||
corrigé L'image nette se trouve sur la rétine. écrire la formule de conjugaison : C= 1/OA'- 1/OA. ( OA' et OA sont algébriques) pour une observation à l'infini 1/OA =0 d'où OA'= 1/C=1/60 = 0,0167 m pour une observation à 25 cm : 1/OA' = 60 ( l'oeil accomode) l'objet se trouve devant la lentille ; la lumière se propage de gauche à droite ; l'origine de l'axe optique est le centre de la lentille : OA = -0,25 m C= 60 - 1/(-0,25) = 64 d.
distance focale = inverse de la vergence = 1/20,286 = 0,0492 m
= 4,9 cm.
exprimé 3 degrés en radians :a=3*3,14 / 180 = 5,23 10-2 rad. hauteur de l'image (m) = a (radian)* distance focale(m) distance focale (m) = inverse de la vergence en dioptries = 1/20 = 0,05 m hauteur image = 5,23 10-2 *0,05 = 2,6 10-3 m = 2,6 mm.
|
||||||||||||||||||||||||||||||||||||
corrigé 23892U--> 23490X + 42He lors d'une émission alpha : le nombre de masse diminue de 4 et le numéro atomique diminue de 2. 23490X --> 23491Y + 0-1e lors d'une émission béta : le nombre de masse ne change pas et le numéro atomique augmente de 1. en passant de 23892U au plomb 20682Pb il faut x désintégrations alpha et y désintégrations béte. 238-206 = 32 = 4x soit x=8 92-82=10 = 2x -y
soit y = 6
A0 = 3 108 Bq et A(t=45s) = 3/8 108=3,75 107 Bq constante radioactive : l= ln2 / t½ = 0,046 s-1. A0=lN0 soit N0 = 3 108 / 0,046 = 6,52 109 noyaux initiaux N= N0/8
= 8,15 108 noyaux à la date t=45 s.
ln (A0/A)= ln2 t / t½ soit t = t½ ln (A0/A)/ ln2 t = 5590*ln(13,5/4,8)/ 0,693 = 8340 ans.
|
||||||||||||||||||||||||||||||||||||
corrigé 2BrO3- + 12H+ + 10 e- = Br2 + 6 H2O réduction de l'oxydant BrO3- {2Br- = Br2 + 2e- } fois 5 oxydation du réducteur Br-. ( c- est vrai) 2BrO3- + 12H+ + 10Br- = 6Br2 + 6 H2O Br2 seule espèce colorée rouge brun. vitesse de la
réaction : 1/V dnBr2 /dt = d[Br2]/dt = -10/6 d[Br-]/dt=
-2/6 d[BrO3-]/dt
à partir de 0,01 mol aspartame, la combustion peut donner ½y *0,01 = 0,005 y mole d'eau d'où 0,005 y = 1,62 /18 = 0,09 soit y=18. 12x / 57,14 = y / 6,12 = 16 z / 27,22 = 14 t / 9,52 x= 57,14*18 / (6,12*12) = 14 carbone. z = 18*27,22 / (16*6,12)= 5 atomes d'oxygène t= 9,52*18
/(14*6,12)= 2 atomes d'azote.C14H18O5N2 .
toutes les concentrations initiales étant identiques Qr,i <
K constante d'équilibre, donc évolution dans le sens direct
prendre la racine carrée : 3,16 = (2,5+xéq)/ (2,5-xéq) 3,16 ((2,5-xéq) = 2,5+xéq soit xéq = 1,3 mmol Qté de matière finale d'ion méthanoate : 2,5+1,3 = 3,8 mmol. taux d'avancement final = xéq/xmax= 1,3/2,5 = 0,52. b, d, e sont
vraies.
évolution dans le sens direct si le quotient initial est inférieur à la constante d'équilibre en éliminant l'un des produits au fur et à mesure qu'il se forme l'équilibre est déplacé dans le sens direct. a et e sont
vraies.
NH3 réagit partiellement avec l'eau donc NH4+ minoritaire dans une solution d'ammoniac la solution d'ammoniac est basique donc l'ion oxonium est minoritaire. HClO=ClO- + H+ ; Ka2 = [ClO-][H+]/[HClO] HClO + NH3= NH4+ +ClO- K= [NH4+][ClO-]/([HClO][NH3]) = Ka2/Ka1 K = 10 exposant (pKa2-pKa1) = 10(9,2-7,3) = 101,9 = 79. a, b, c et e
sont vraies.
2 I- = 2e-+ I2
avancement = Qté de matière diiode = [I2] car le volume total est 1L La pente de la tangente à la courbe [I2] = f(t) donne la vitesse volumique de la réaction : à t=0 celle-ci est maximale car la concentration des réactifs est alors maximale, puis va décroître au cours du temps. b, c, d et e
sont vraies.
HCOOH + H2O=HCOO-+H3O+; K= [HCOO-]éq[H3O+]éq/[HCOOH]éq ; s =l (H3O+) [H3O+]éq + l(HCOO-)[HCOO-]éq avec [H3O+]éq = [HCOO-]éq = xéq/V volume en litre s =(l (H3O+)+ l(HCOO-))xéq/V avec le volume de la solution en m3. 7,28 10-2 = (35+5,54 ) 10-3 xéq/10-4d'où xéq= 1,8 10-4 mol. [H3O+]éq = [HCOO-]éq =1,8 10-4 /0,1 = 1,8 10-3 mol/L [HCOOH]éq = 0,02-1,8 10-3 = 1,82 10-2 mol/L K= 1,8 10-3
1,8 10-3 / 1,82 10-2 = 1,82 10-4 .
Qté de matière triester : ( la soude est en large excès) 900 kg/m3=0,9 g/mL ; masse huile 0,9*11 = 9,9 g masse huile (g) / masse molaire (g/mol) = 9,9 / 884 = 0,0112 mol en conséquence 0,0112*3 = 0,0336 mol savon masse savon :
0,0336 *303 = 10,18g.
Quantité d'électricité (C) = intensité (A)*durée (s) 1,5*(3600*2+35*60)=13950 COr la charge d'une mole d'électrons est 96500 C, d'où la Qté de matière d'électrons 13950 / 96500 = 0,144 mol par suite la Qté de matière de dioxygène est : 0,25*0,144 = 0,036 mol volume dioxygène (L) = Qté de matière (mol) * volume molaire des gaz 0,036*25 = 0,9 L.
K=( 9,7 10-3)2/3 10-4 = 0,31. Qr,i = [Ag+]i[Fe2+]i/[Fe3+]i =0 car la concentration en ion Ag+ est initialement nulle. a, d, e vraies.
|
||||||||||||||||||||||||||||||||||||
|
|