En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
| .
. |
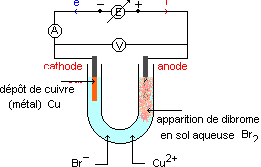
A la cathode négative :
Cu2+ + 2e- = Cu , gain d'électrons, c'est une réduction.
A l'anode positive :
2Br- = Br2 + 2e- , perte d'électrons c'est une oxydation.
Cette transformation forcée est appelée électrolyse.
L'electrode à laquelle se produit une oxydation est appelée anode (électrode par laquelle le courant entre dans l'électrolyseur).
L'électrode à laquelle se produit une réduction est appelée cathode (électrode par laquelle le courant sort de l'électrolyseur).
On effectue l'électrolyse de 200 mL d'une solution acidifiée
de nitrate d'argent de concentration C=0,05 mol/L. On réalise cette
électrolyse entre deux électrodes de graphite. L'argent se dépose à la
cathode et du dioxygène se dégage à l'anode. L'électrolyse à durer 20
min avec un courant constant d'intensité I= 612 mA. La température du
laboratoire est 17° et la pression de 1013 hPa.
couple oxydant /réducteur Ag+/Ag ; O2/H2O.
NA= 6,02 1023 mol-1 ; e= 1,6 10-19
C ; R= 8,31 J mol-1K-1.
- Déterminer la masse d'argent déposée à la cathode.
- En déduire la concentration finale ( en mmol/L) en ion argent dans la solution.
- calculer le volume ( en mL) de dioxygène dégagé au cours de
l'électrolyse.
corrigé
Quantité d'électricité : Q=It= 0,612 *20*60 = 734,4 C
Qté de matière d'électrons : 734,4/96500= 7,6 10-3 mol
Ag++e-=Ag donc 7,6 10-3 mol d'argent ; 7,6 10-3 *108 = 0,82 g d'argent déposé à la cathode
Qté de matière d'ion argent :
initial : 0,2*0,05 = 0,01 mol
disparaît : 7,6 10-3 mol
reste : 2,4 10-3 mol dans 0,2 L; [Ag+]= 2,4 10-3 /0,2 = 0,012 mol/L.
H2O = ½O2+2H++2e-
Qté de matière O2 = 0,25 Qté de matière d'électrons = 1,9 10-3 mol
volume molaire des gaz : Vm= RT/P= 8,31*(273+17) / 1,013 105 = 23,8 L
puis 23,8*,9 10-3 = 0,0452 L = 45,2 mL de dioxygène.
|
|
Certains métaux sont préparés par électrolyse d'une solution aqueuse les contenant à l'état de cations. Le zinc est obtenu par électrolyse d'une solution de sulfate de zinc acidifiée par l'acide sulfurique. Les ions sulfates ne participent pas aux réactions électrochimiques. On observe un dépôt métallique sur l'une des électrodes et un dégagement gazeux sur l'autre.
A- étude théorique :
- Quelles sont les réactions susceptibles de se produire sur chaque électrode sachant que c'est le solvant qui est oxydé en dioxygène. Couples redox : Zn2+ / Zn (s) ; H+/ H2(g) ; O2(g) / H2O.
- Schématiser l'électrolyseur, en précisant le nom de chaque électrode et le sens de déplacement des espèces chargées.
- En justifiant le choix des couples, vérifier que l'équation
globale de cette électrolyse est :
Zn2+ + H2O =Zn (s) + ½ O2(g) + 2H+. - S'agit-il d'une transformation spontanée ou forcée ? Pourquoi ? Quelle vérification théorique proposeriez-vous ?
- Etablir le tableau d'avancement correspondant à la réaction d'électrolyse.
B- Etude quantative :
L'électrolyse a lieu sous 3,5 V. L'intensité du courant peut atteindre 80 kA. Après 48 heures de fonctionnement, le dépôt de zinc est suffisamment épais.
- Quelle est la relation entre l'avancement x et la quantité d'électricité Q transportée dans cet électrolyseur ?
- Quel est l'ordre de grandeur de la masse de zinc produite par une cellule en 2 jours ?
- En fait on obtient une quantité de zinc inférieure à celle attendue. Pourquoi ?
- A l'autre électrode on récupère le dioxygène. Le rendement de la réaction qui le produit est de 80 % et le volume molaire de 24 L/mol. Donner la relation entre l'avancement x et le volume V de dioxygène récupéré. Quel est l'ordre de grandeur de V ?
masse molaire du zinc :65 g/mol ; masse volumique du zinc r =7 g/cm3 ; 1 faraday = 105 C
calculs : 65*8*48*36=9 105 ; 8*48*36=14 000 ; 65*48 /(8*36)=10 ; 8*48/36 =10
corrigé
à la cathode négative se produit une réduction
Zn2+ + 2e- = Zn (s)
2H+ + 2e- = H2(g)
à l'anode positive se produit une oxydation
H2O = ½O2 + 2H++ 2e-
bilan de l'électrolyse : Zn2+ +H2O = ½O2 +2H++ Zn (s)
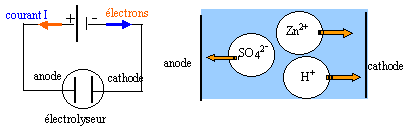
l'électrolyse est
une transformation forcée nécesitant un apport d'énergie électrique. La
réaction spontanée est l'attaque ( oxydation ) du zinc métal par un
acide. Le zinc est plus réducteur que l'eau.
C= concentration (mol/L) en ion zinc et V volume de la solution en
litre.
Zn2+ + 2e- = Zn (s)
la quantité de matière d'électrons est égale à 2 fois la quantité de matière de zinc soit 2x
la charge d'une mole d'électrons vaut , en valeur absolue 96 500 C environ 105 C
Q=2 x 105 coulombs
d'autre part Q= I(A) t( s) = 8 104 * 48*3600 =8*48*36 106 = 14 109 C
d'où x =14 109 /(2 105) = 7 104 mol
masse de zinc :(g) = masse molaire (g/mol) * Qté de matière (mol) = 65*7 104 = 4,55 106 g = 4,55 tonnes.
à la cathode une réduction concurente se produit : 2H+ + 2e- = H2(g)
la masse réelle
de zinc sera donc plus faible.
à l'anode H2O = ½O2 + 2H++
2e-
la quantité de matière de dioxygène est 4 fois plus faible que la quantité de matière d'électrons :0,25 * 7 104 mol
volume de dioxygène : 24*0,25*7 104 = 4,2 105 L = 420 m3
en tenant compte
du rendement 420*0,8 = 336 m3.
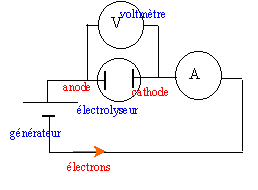
Le cadmium est obtenu par électrolyse d'une solution aqueuse de sulfate de cadmium ( Cd2+ ; SO42-) et d'acide sulfurique ( 2H+ ; SO42-). Les ions sulfate ne réagissent pas.Couples oxydant-réducteur : Cd2+(aq) / Cd(s); H+(aq) / H2(g) ; O2(g) / H2O(l). La tension aux bornes de la cuve à électrolyse vaut U = 3 V et l'intensité ducourant vaut I = 20 kA
- Faire le schéma et placer les appareils de mesure de la tension et de l'intensité.
- Quel est le sens de déplacement des électrons ?
- Sur quelle électrode le cadmium se dépose-t-il ? Ecrire la demi-équation correspondante. Préciser s'il s'agit d'une réduction ou d'une oxydation ?
- Il se produit un dégagement gazeux à l'autre électrode. En utilisant les couples oxydant-réducteur identifier le gaz formé.
- Etablir un tableau d'avancement pour la demi-équation liée à la formation du cadmium. En déduire la quantité de matière en cadmium formée pendant la durée t en fonction de l'intensité dans le circuit, la durée t et du Faraday noté F. t = 965 s. 1F = 96500 C/mol.
corrigé
à la cathode négative se produit une réduction des ion Cd2+.
Cd2+ + 2e- = Cd (s)
à l'anode positive se produit une oxydation de l'eau
H2O = ½O2 + 2H++ 2e-
bilan de l'électrolyse : Cd2+ +H2O = ½O2 +2H++ Cd (s)
Quantité d'électricité traversant la cuve en t seconde Q= It = 2x
fin F
Qté de matière de cadmium formé en t seconde : xfin = It / (2F)
xfin
=2 104*965 / (2*96500) = 100 mol.