En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
| .
. |
Polarité de la pile :
Le signe de la valeur lue sur le voltmètre correspond à la polarité de l'électrode à laquelle la borne de mesure V est reliée.
A la borne négative se produit une oxydation :
A la borne positive se produit une réduction :
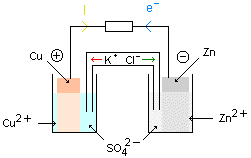
- Zn / Zn2+ // Cu2+ / Cu +.
Quantité d'électricité maximale Q ( coulomb) débitée par la pile
Q = I Dt.
Dt : durée de fonctionnement en seconde et I intensité en ampère.
Soit n la quantité de matière d'électrons fournie par le réductuer pendant Dt, alors :
n : mole d'électrons
Un élève veut réaliser une pile zinc argent et dispose pour cela d'une lame d'argent, d'une lame de zinc, d'un bécher contenant un volume V1 = 100 mL de solution aqueuse de nitrate d'argent de concentration initiale en ion argent C1 = 0,2 mol/L, d'un bécher contenant un volume V2= 100 mL de solution de sulfate de zinc de concentration initiale en ion zinc C2 = 0,1 mol/L, d'un pont ionique au nitrate de potassium saturé. Le volume de chaque lame métallique est 10 mL.
Pour vérifier son fonctionnement il dispose d'un voltmètre,
d'un ampèremètre d'un conducteur ohmique de résistance R et d'un
interrupteur.
couples Ag+/Ag ; Zn2+/Zn
Constante d'équilibre de la réaction entre le zinc métal et les ions argent : K= 1052.
Masse molaire atomique (g/mol) : Ag : 107,9 ; Zn : 65,4.
masse volumique (g/mL) mAg= 7,1 : m Zn = 10,3.
A sens d'évolution spontané du système :
- Ecrire une équation de réaction possible décrivant le fonctionnement de la pile.
- Calculer le quotient initial Qr,i.
- En déduire le sens d'évolution spontané du système chimique.
- Ecrire l'équation de la réaction associée à la transformation qui a effectivement lieu lors du fonctionnement de la pile.
- En déduire les équations des réactions aux électrodes.
- Donner la notation symbolique de cette pile.
B Pile en fonctionnement :
L'élève réalise la pile et branche un voltmètre aux bornes de celle-ci.
- Faire le schéma annoté du circuit en indiquant, les polarités de la pile, les bornes COM et V du voltmètre, le sens du courant électrique, le sens de déplacement de tous les porteurs de charges en le justifiant.
- L'élève réalise à présent un circuit en plaçant en série la
pile, l'ampèremètre, le conducteur ohmique et l'interrupteur. Il ferme
celui-ci et un courant électrique de 965 mA circule pendant 5 min.
- Déterminer les concentrations finales en ions métalliques dans chaque demi-pile.
- Déterminer les masses finales de chaque électrode.
|
|
corrigé
Zn(s) + 2Ag+ = Zn2+
+ 2Ag(s)
Qr i =[ Zn2+] /[Ag+]²= 0,1/0,2²= 2,5
valeur inférieure à K, donc évolution dans le sens direct.
à l'anode négative, le zinc s'oxyde : Zn(s) = Zn2+ + 2e-.
à la cathode positive, les ions argent se réduisent : 2Ag+ + 2e- = 2 Ag(s)
- Zn / Zn2+ // Ag+ / Ag +
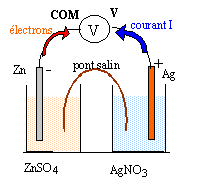
en solution : les ions Zn2+ migrent vers le zinc métal ; les ions sulfates négatifs migrent en sens contraire
les ions argent positif s'éloignent de l'argent métal; les ions nitrates négatif migrent en sens contraire.
dans le pont salin : la demi pile de droite s'appauvrit en ion Ag+ : pour conserver l'électroneutralité de la solution les ions K+ du pont salin y migrent.
la demi pile de gauche gagne des ions Zn2+
: pour conserver l'électroneutralité de la solution les ions NO3-
du pont salin y migrent.
Qté d'électricité mise en jeu : Q=I t = 0,965 *
5*60 = 289,5 C
Or la charge d'une mole d'électrons vaut en valeur absolue 96500 C
Qté de matière d'électrons :0,965 * 5*60 / 96500 = 3 mmol
Zn(s) = Zn2+ + 2e-.
Qté de matière de zinc disparu : 1,5 mmol soit en masse 65,4*1,5 10-3 = 0,098 g
initialement 10*10,3 = 103 g de zinc
masse finale de zinc :103-0,098 = 102,9 g.
Qté de matière d'ion zinc apparu : 1,5 mmol
initialement on avait 100*0,1 = 10 mmol d'ion zinc
au total 11,5 mmol ion zinc dans 100 mL : [Zn2+]=11,5/100 = 0,115 mol/L.
Ag+ + e- = Ag(s)
Qté de matière d'agent formé : 3 mmol soit en masse 107,9*3 10-3 = 0,32 g
initialement 10*7,1 = 71 g d'argent
masse finale d'argent : 71,32 g.
Qté de matière d'ion agrent disparu : 3 mmol
initialement on avait 100*0,2 = 20 mmol d'ion argent
au final 17 mmol d'ion argent dans 100 mL : [Zn2+]=17/100 = 0,17 mol/L.