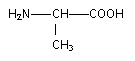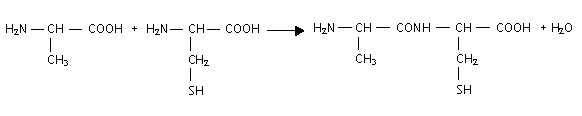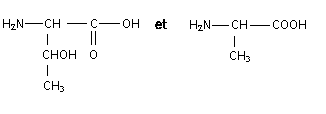|
|
|||||
|
|
|||||
|
|||||
|
|
Données : Masse molaire atomique du chlore : MCl = 35,5 g.mol-1. On rappelle qu'un oxydant est une espèce chimique capable de gagner des électrons alors qu'un réducteur est une espèce chimique capable de céder des électrons. L'eau de Javel est obtenue par dismutation du dichlore Cl2 en milieu basique. L'équation de la réaction de dismutation s'écrit : Cl2 + 2(Na+ + HO-) ---> Na+ + ClO- + Na+ + Cl- + H2O.
corrigé Cl2 + 2e- = 2Cl-. le chlore gagne des électrons : c'est l'oxydant du couple redox Cl2/Cl-. On appelle degré ou titre chlorométrique d'une eau de Javel le volume de dichlore, mesuré en litres dans les conditions normales de température et de pression, nécessaire à la fabrication d'un litre de cette eau de Javel. masse molaire du dichlore : 35,5*2 = 71 g/mol. quantité de matière n (mol) de dichlore = masse (g) / masse molaire (g/mol) = 35,5/71 = 0,5 mol. degré chlorométrique de l'eau de Javel ainsi fabriquée : 11,2 ° Chl. cet ajout d'eau dans la solution est une dilution. le degré chlorométrique t de l'eau de Javel obtenue est 1,12 °Chl car on a dilué 10 fois la solution initiale ( volume initial = 1 L ; volume final = 10 L) 2I- + ClO- + H2O = I2
+ Cl- + 2HO-.
|
||||
|
Le molybdène 9942Mo est un radionucléide dont la désintégration spontanée produit du technétium 9943Tc.
corrigé 9942Mo = 9943Tc +AZX la charge électrique se conserve : 42 = 43 + Z soit Z= -1 le nombre de nucléons se conserve : 99 = 99 +A soit A=0 la particule X est identifiée à un électron. La "période radioactive" ou demi-vie d'un radionucléide est la durée au bout de laquelle la moitié des noyaux radioactifs initiaux s'est désintégrée. C'est encore la durée au bout de laquelle l'activité de l'échantillon est divisée par deux. au bout de 6 heures A1 = ½A0 = 0,5 * 5,6 107 = 2,8 107 Bq. au bout de 12 heures A2 = ½A1 = A0/22=0,25 * 5,6 107 = 1,4 107 Bq. 120 h correspondent à 20 périodes. au bout de 120 heures A20 = A0/220 = 5,6 107 /220 = 53 Bq.( la dose est inactive) 1 jour = 24 h donc 120 h = 5 jours (moins d'une semaine). Un examen qui utilise le technétium ne peut pas être réalisé quelques semaines après l'injection de la dose.
|
|||||
|
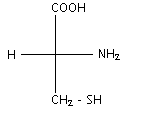
La cystéine est un acide a -aminé de formule semi-développée : 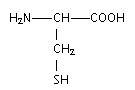
corrigé 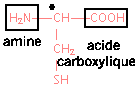
un carbone asymétrique est lié à qutre atomes ou groupes d'atomes différents.
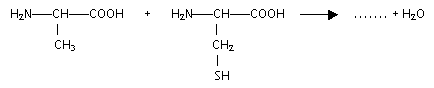
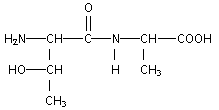
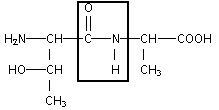
encadrer la liaison peptidique : formules semi-développées des acides a -aminés mis en jeu dans la synthèse de ce dipeptide
|
|||||
|
|