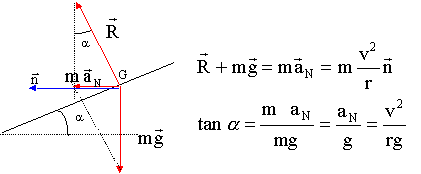|
QCM physique : durée 1 h ; 20 points.
Selon les questions, une ou plusieurs réponses sont exactes.
On prendra pour le champ de pesanteur g = 10 N.kg-1 ;
Constante d'Avogadro: NA = 6,0.1023
mol-1 ;
Masse d'un nucléon: mn = 1,7.10-27 kg
On pourra utiliser les approximations: Tf = 10 ;
In2 = 0,69; In100 = 4,6.
- La célérité du son dans un gaz est donnée par v = [ap/m]½ où p est la pression du gaz, m sa masse volumique et a une constante dépendant
de la nature du gaz.. Quelle est l'unité de a ?
a) pas d'unité
b) kg m3 s-2.
c) g cm3 s2.
d) m-3/2 s-1.
e) m-2/3 s1/2.
a= v²m/p ;
vitesse -2 : (longueur/temps)2 soit m2
s-2 ; m : masse(kg) / volume m3
soit kg m-3 ; v²m : kg m-1s-2
pression (Pa) = force (N) / surface (m²) = masse (kg) *
accélération (m/s²)/ surface (m²) soit : kg kg m-1s-2
réponse a : correcte
- Un haut-parleur émet une onde sonore progressive
sinusoïdale de fréquence 700 Hz. Deux microphones sont placés dans
l'axe du haut-parleur, séparés par une distance d. La distance d = 50
cm est la distance minimale pour que les ondes reçues par les
microphones vibrent en phase.
Si l'expérience était réalisable dans un liquide où la célérité du son
est de 1400 m.s -1, pour quelle distance minimale les ondes
vlbreraient-elles en opposition de phase ?
a) 50 cm
b) 1 m
c) 2 m
d) 3 m
e) 4 m.
Dans le liquide : v= l f
soit l = v/f = 1400/700 = 2 m
distance minimale séparant deux points en opposition de phase : ½l = 1 m
réponse b : correcte
- Un vêtement rouge à la lumière du jour réémet
principalement une radiation de longueur d'onde l0
= 630 nm dans l'air. Quelle est la longueur d'onde de
cette radiation dans l'eau, d'Indice de réfraction n = 4/3 ?
a) 473 nm
b) 630 nm
c) 643 nm
d) 649 nm
e) 712 nm.
lair = c f ; leau = ceau f ; lair /leau
= c/ ceau = n
soit leau =lair
/n = 630/(4/3) = 630*3/4=473 nm
réponse a : correcte
- On étudie la largeur angulaire 2q d'un
faisceau de lumière monochromatique diffracté par une fente fine. Parmi
les affirmations suivantes, laquelle (lesquelles) est (sont) vrale(s) ?
La largeur du faisceau est:
a) inversement proportionnelle à la largeur de la fente notée a ~
b) proportionnelle à la largeur de la fente
c) indépendante de la largeur de la fente
d) proportionnelle à la longueur d'onde
e) indépendante de la longueur d'onde.
q=l/a
réponses a et d : correctes
- L'astate 210 est radioactif b+,
de demi-vie égale à 8 h. On dispose d'un échantillon d'astate de 210 g.
Combien de noyaux d'astate reste-t-il au bout d'une journée ?
a) 3 1029.
b) 1,2 1021.
c) 7,5 1022.
d) 2 1023.
e) 4,8 1024.
masse (g) / masse molaire (g/mol) = 210/210 = 1 mol
soit N0=6 1023 noyaux initialement
à t = t½=8 h , il reste 0,5N0 noyaux
à t =2 t½=16 h , il reste 0,25N0 noyaux
à t = 3t½=24 h , il reste 0,1255N0 noyaux soit 7,5 1022.
réponse c : correcte
- Le césium 137 est un élément radioactif de demi-vie t1/2
= 30 ans. La durée nécessaire à la disparition de 99% d'un échantillon
de césium 137 est d'environ:
a) 20 ans.
b) 30 ans.
c) 120 ans.
d) 140 ans.
e) 200 ans.
à t = t½=30 ans , 50% de noyaux ont
disparu
à t =2 t½=60 ans , 75% de noyaux ont disparu
à t =3 t½=90 ans , 87,5% de noyaux ont disparu
à t =4 t½=120 ans , 93,7% de noyaux ont disparu
à t =5 t½=150 ans , 96,8% de noyaux ont disparu
à t =6 t½=180 ans , 98,5% de noyaux ont disparu
à t =7 t½=200 ans , 99,1% de noyaux ont disparu
réponse e : correcte
- Les bornes d'un générateur (E = 12 V ; r = 2W ) sont reliées à celles d'un moteur électrique
(E'= 6 V ; r'= 8 W ). Quelle est la
puissance électrique consommée par le moteur ?
a) 0,7 W.
b) 2,3 W.
c) 3,6 W.
d) 4,5 W.
e) 6,5 W.
P(W) = U(V) I(A)
avec U= E-rI aux bornes du générateur et U= E'+r' I aux bornes du moteur
d'où I= (E-E')/(r+r')= (12-6)/10=0,6 A
U= 12-2*0,6 = 10,8 V ; P= 10,8*0,6 = 6,48 W
réponse e : correcte
-
- Parmi les affirmations suivantes, laquelle (lesquelles) est
(sont) vraie(s) ? Le condensateur est un dipôle:
a) qui laisse passer le courant continu.
b) qui s'oppose aux variations de l'intensité du courant dans le
circuit.
c) dont les deux armatures sont reliées par un fil conducteur
d) qui peut stocker des charges électriques
e) équivalent à une résistance.
réponse d : correcte
- Le circuit schématisé ci-dessous est constitué d'une source
de courant qui débite une intensité constante 1 = 5,0 mA, d'un conducteur ohmique de résistance R = 500
kW, d'un condensateur de capacité C = 5,0 m F et d'un interrupteur K. Le condensateur est
initialement déchargé. À l'instant t = 0, on ferme l'interrupteur K.
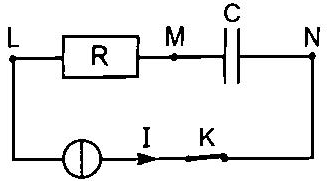
Quelle est, à l'instant t = 10 s, la puissance fournie par
le générateur au circuit ?
a) elle est nulle
b) 12,5 mW
c) 37,5 m W
d) 50 m W
e) 62,5 m W
puissance fournie par le générateur à t= 10 s :
à t = 10 s la tension aux bornes du circuit vaut :
aux bornes du résistor : RI= 5 105*5 10-6=
2,5 V
aux bornes du condensateur : Q/C=It/C= 5 10-6*10/5 10-6
= 10 V
Utotal = 2,5 + 10 = 12,5V
puissance à cet instant t= 10 s : P =U*I = 12,5*5 10-6
= 62µW
réponse e : correcte
- Un générateur de f.é.m. E = 12 V charge un condensateur de
capacité C = 1000 m F à travers une
résistance R = 100 kW. A quelle date le
condensateur sera-t-il chargé à 50 % ?
a) 33 s
b) 50 s
c) 63 s
d) 69 s
e) 10 s
constante de temps t =
RC= 105*10-3 = 100 s.
uc= E exp(-t/t) soit ln (uc/
E)= -t/t ; t = ln (E/uc) t = ln 2*100 = 69 s.
réponse d : correcte
- Un circuit oscillant de type LC, utilisé dans un récepteur
radio, est formé d'une bobine d'inductance L = 0,50 m
H et d'un condensateur de capacité C. La fréquence
propre de ce circuit vaut f0 = 10 MHz. Quelle est la valeur
de la capacité C ?
a) 0,5 nF
b) 2 nF
c) 5 nF
d) 10 nF
e) 20 nF
L= 5 10-7 H ; f0 = 107
Hz ; w= 2p 107
rad/s ;
à la résonance : LCw²=1 soit C= 1/(Lw²)= 1 / (5 10-7*(2p
107 )²)=10-7 / 200 = 10-9/2 = 0,5 nF
réponse a : correcte
- Deux pierres sont lancées verticalement du même point et au
même instant, l'une vers le haut, l'autre vers le bas, à la même
vitesse de 8 m/s. En négligeant la résistance de l'air, quelle sera la
distance entre les deux projectiles 5 secondes après leur départ,
aucune pierre n'ayant touché le sol ?
a) nulle
b) 9,8 m
c) 25 m
d) 43 m
e) 80 m
origine du repère : le sol ; axe vertical vers le
haut.
bille lancée vers le haut : z1= -½gt²+v0t+h
bille lancée vers lebas : z2= -½gt²-v0t+h
z1-z2 = 2v0t = 2*8*5 = 80 m
réponse e : correcte
- Une fusée de masse au décollage 200 tonnes est propulsée
verticalement par une force de poussée de ses réacteurs de valeur égale
à 2400 kN.Quelle est, au décollage, l'accélération de la fusée?
a) 1 m/s²
b) 2 m/s²
c) 4 m/s²
d) 10 m/s²
e) 12 m/s²
poussée verticale vers le haut : 2,4 106 N
poids vertical vers le bas : mg= 2 105*10 = 2 106
N
la seconde loi de Newton s'écrit suivant un axe vertical ascendant :
(2,4-2) 106 = 2 105 a soit a = 2 m/s²
réponse b : correcte
- Une pierre, lancée vers le haut depuis la surface terrestre
avec une vitesse initiale v0, atteint une altitude maximale
de 12 m. On néglige tout frottement. Sachant que la pesanteur lunaire
est le 1/6 de la pesanteur terrestre, quelle serait l'altitude maximale
atteinte par la pierre, lancée depuis le sol lunaire avec la même
vitesse initiale?
a) 6 m
b) 12 m
c) 72 m
d) 84 m
e) 432 m
v²0 = 2 gh
si g est divisée par 6 alors, pour une même vitesse initiale, h est
multipliée par 6 soit 12*6 = 72 m.
réponse c : correcte
- Un cycliste tourne à vitesse constante v selon une
trajectoire circulaire de rayon r sur une piste de vélodrome. La piste
est relevée d'un angle a. par rapport à
l'horizontale de manière à ce que la réaction du sol sur le cycliste
soit perpendiculaire à la piste. Quelle est la relation vérifiée par
l'angle a.
a) sin a = v/(rg)
b) sin a = v²g/r
c) cos a = gr/v²
d) cos a = g/(rv²)
e) tan a = v²/(rg)
réponse e : correcte
- Une balle est lancée depuis le sol horizontal avec une
vitesse inclinée de 50° sur l'horizontale, et de valeur V0.
La balle retombe ensuite sur le sol. On néglige tout frottement.
Comment varie la durée de la chute libre de la balle lorsque V0
varie ?
a) elle ne dépend pas de V0
b) elle est proportionnelle à V0
c) elle est proportionnelle à V02
d) elle est inversement proportionne/le à V0
e) elle est inversement proportionnelle à V02
portée du tir : x= 2 v²0sina cosa/g
d'autre part x= v0cos a t
d'où : 2 v²0sina cosa/g = v0cos a
t ; t = 2 v0sina/g
réponse b : correcte
- Un oscillateur linéaire horizontal est constitué d'un
ressort de masse négligeable, de raideur k et d'un solide de masse m.
On donne une compression X0 au système et on le libère. La
période des oscillations est T0. On remplace le solide de
masse m par un autre solide de masse m' puis on libère l'oscillateur
dans les mêmes conditions que précédemment. La période augmente de 50%.
Quelle relation exlste-t-iI entre l'énergie cinétique maximale Ec
max du solide de masse m et l'énergie cinétique maximale E' c
max du solide de masse m' ?
a) E' c max = 0,4 Ec max
b) E' c max = 0,67 Ec max
c) E' c max = Ec max
d)E' c max = 1,5 Ec max
e) E' c max = 2,25 Ec max
Conservation de l'énergie mécanique :
donc l'énergie cinétique maximale est égale à l'énergie potentielle
élastique maximale soit ½kX02.
Les conditions initiales étant identique, l'énergie cinétique maximale
reste constante.
réponse c : correcte
- La suspension d'un véhicule permet d'atténuer les
oscillations verticales de celui-ci. Elle est constituée au niveau de
chaque roue d'un ressort et d'un amortisseur. Ainsi l'ensemble du
véhicule est assimilé à un oscillateur mécanique unique vertical,
amorti, de masse m posée sur un ressort de raideur k. Le comportement
de cet oscillateur vertical est identique à celui d'un oscillateur
horizontal.
Sur une route comportant une succession régulière de bosses distantes
de L, pour une certaine vitesse V du véhicule, il subit des
oscillations verticales de forte amplitude. Quelle est l'expression de
cette vitesse V ?
a) 2p/L(m/k)½.
b) L/(2p)(m/k)½.
c) L/(2p)(k/m)½.
d) L/(km)½.
e) Lm/k
résonateur T0 = 2p(m/k)½.
f0 = 1/T0 = 1/( 2p)
(k/m)½.
excitateur ( la route ) : fréquence f = V/L
à la résonance f= f0 soit : V/L = 1/( 2p)
(k/m)½.
V= L/( 2p) (k/m)½.
réponse c : correcte
- Une horloge à balancier, assimilable à un pendule simple,
est construite pour être exacte au niveau de la mer. On l'amène au
sommet du Mont Blanc, où son fonctionnement est perturbé. Comment
modifier l'horloge pour qu'elle soit à nouveau exacte ?
a) raccourcir le balancier.
b) allonger le balancier.
c) augmenter la masse à l'extrémité du balancier
d) diminuer la masse à l'extrémité du balancier
e) modifier l'amplitude du mouvement du balancier
T0 = 2p(L/g)½.
au sommet g est plus petit qu'au niveau de la mer : pour conserver la
même période il faut diminuer L, la longueur du balancier.
réponse a : correcte
- L'orbite de Mercure dans le référentiel héliocentrique est
très nettement elliptique. Où est situé le centre du Soleil par rapport
à cette trajectoire ?
a) au centre de l'ellipse
b) au périhélie de l'ellipse
c) à l'un des foyers de l'ellipse
d) entre le centre et un foyer de l'ellipse
e) il n'occupe pas de position particulière par rapport à l'ellipse
réponse c : correcte
|
|
QCM chimie ( 30 min : 10 points) :
- On étudie la vitesse volumique de réaction v (appelée
simplement vitesse de réaction) d'une transformation chimique modélisée
par l'équation de réaction: aA + bB = cC + dD
Donnée : le volume du mélange réactionnel reste constant au cours de la
transformation chimique envisagée.
Quelle(s) est (sont) 1'(les) afflrmation(s) exacte(s) ?
a) la vitesse de réaction est définie par v =1/V dx/dt, x étant
l'avancement de la réaction et V le volume du milieu réactionnel
b) La vitesse de réaction en fonction de la concentration [A] de
l'espèce a pour expression: v = 1/a d[A]/dt
c) la vitesse de réaction est une grandeur qui peut être négative .
d) la vitesse de réaction est indépendante du volume du mélange
réactionnel
e) la vitesse de réaction augmente avec la température.
|
aA
|
+ bB
|
= cC
|
+ dD
|
|
initial
|
na mol
|
nbmol
|
0
|
0
|
|
en cours
|
na -ax
|
nb- bx
|
c x
|
d x
|
[A]=(na -ax)/V ; d[A]/dt = -a/V dx/dt
réponses a et e : correctes
- Le palmitate de myricyle CH3-(CH2)14COO-(CH2)29-CH3,
est le principal constituant de la cire d'abeille. Dans un ballon, on
traite à chaud n moles de palmitate de myricyle introduites dans V mL
d'éthanol, 50 ml d'une solution alcoolique d'hydroxyde de potassium de
concentration = 0,60 mol/L.
Au bout d'une heure, l'ensemble est refroidi, puis on procéde au
titrage de la quantité d'ions hydroxyde restants dans le ballon. Il
faut 6 mL d'acide chlorhydrique de concentration molaire 0,25 mol/L
pour atteindre l'équivalence. Aprés relargage, on obtient une masse m
de savon.
Données: Masses molaires en g/mol : H: 1 ; C: 12; 0: 16; K: 39.
Quelle(s) est (sont) 1'(les) affirmation(s) exacte(s) ?
a) la réaction étudiée est une hydrolyse basique.
b) la réaction étudiée est une estérification
c) le relargage est obtenu grâce à la présence de l'éthanol dans le
milieuréactionnel
d) la formule semi-développée du savon est : CH3(CH2)
14-COO-.
e) la masse de savon obtenue est de l'ordre de 7,4 g
hydrolyse basique ou saponification lente, totale.
relargage : le savon précipite dans l'eau salée.
savon : CH3(CH2) 14-COO- ;
K+. M(savon) = 16*12+31+32+39=294 g/mol
potasse initiale :0,6*50 = 30 mmol
potasse restant dosée par l'acide : 0,25*6 = 1,5 mmol
potasse ayant réagi : 30-1,5 = 28,5 mmol
donc 28,5 mmol de savon ou 0,0285*294 = 8,4 g.
réponse a : correcte
- Une solution aqueuse d'un monoacide partiellement dissocié
de concentration molaire C = 1,0.10-2 mol.L -1 a
un pH égal à 5,6. Quel est cet acide ?
a) 1 acide méthanoïque : pKA = 3,7
b) acide benzoïque: pKa = 4,2
c) acide éthanoïque: pKa = 4,8
d) acide cyanhydrique: pKa = 9,2
e) acide éthylammonium: pKa =10,6
[H3O+]=10-pH= 10-5,6
mol/L ;
AH + H2O= A- +H3O+ avec [A-]=
[H3O+]
conservation de A : [A-] + [AH]= C ; [AH] = c-[A-]
= 0,01- 10-5,6 voisin 0,01 mol/L
pH= pKa + log([A-]/[AH]) donne pKa = 5,6 - log(10-5,6
/0,01) = 5,6 +3,6 = 9,2
réponse d : correcte
- On réalise la pile suivante: Zn(s)/ Zn2+ (aq) //
Pb2+ (aq) / Pb (s)
Le volume des solutions est V = 100 ml et les concentrations en ions Pb2+
et Zn2+ dans leurs solutions respectives sont:
[Zn2+] = 5,0.10-2 mol/L, [Pb2+]
= 1,0.10-2 mol.l-1
Les lames de métal utilisées pour les électrodes sont épaisses. Un
voltmètre est inséré dans le circuit extérieur, sa borne V est reliée à
la lame de zinc et sa borne " COM " est reliée à la lame de plomb.
Données:
La constante de réaction ayant pour réactifs les ions zinc Zn2+
et le plomb métal Pb a pour valeur K = 2.10-21.
Quelle(s) est (sont) 1'(les) affirmation(s) exacte(s) ?
a) l'équation de réaction de la pile est: Pb2+(aq) + Zn(s) =
Zn2+(aq) + Pb (s)
b) l'équation de réaction de la pile est: Zn2+(aq) + Pb(s) =
Zn(s) + Pb2+(aq)
c) la valeur de la tension affichée au voltmètre est positive
d) à l'intérieur de la pile, les électrons se déplacent de la lame de
zinc vers la lame de plomb
e) quand la pile s'arrête de fonctionner, le quotient de réaction a
pour valeur Qr.eq = 5.
Le zinc s'oxyde : Zn(s) = Zn2+ + 2e-
et constitue la borne négative ( qu'il faut relié au COM du voltmètre
pour lire une valeur positive)
l'ion Pb2+ se réduit : Pb2+ + 2e- =
Pb(s)
bilan : Zn(s) + Pb2+ = Zn2+ +Pb(s) K = 1/ 2 10-21
= 1021/2 = 5 1020.
à l'intérieur des solutions et du pont salin, les ions se déplacent
Dans les plaques et les fils du circuit extérieur, les électrons se
déplacent.
la pile s'arrête de fonctionner lorsque l'un au moins des réactifs à
disparu, ici Pb2+ ( car Zn, plaque épaisse)
[Pb2+]fin voisine de zéro ; [Zn2+]fin
=[Zn2+]initial+ 0,1*0,1 mol ; Qr.fin
=[Zn2+]fin /[Pb2+]fin= K
réponse a : correcte
- On veut étudier la réaction se produisant entre les ions
iodure I- et les ions peroxodisulfate S2082-.
Pour cela on prépare un volume V = 100 ml de solution S en mélangeant
50 ml de solution d'iodure de potassium et 50 ml de solution de
peroxodisulfate de potassium. Les ions I- et S2082-
sont dans les proportions stœchiométriques. La réaction est totale et
lente. Il se forme du diiode I2 que l'on peut doser grâce à
une solution de thiosulfate de sodium (S2032-
+ 2Na+) de concentration connue c'.
On prélève à un instant t, un volume v = 10 ml de la solution S que
l'on maintient dans un cristallisoir d'eau glacée. On dose la quantité
de diiode présente dans ce prélèvement. Pour cela, on doit ajouter un
volume v' = 12 ml d'une solution de thiosulfate de sodium de
concentration c' = 0,10 mol.l-1 pour obtenir l'équivalence.
Données : Couples redox: I2 /I- ; S4062-
/ S2032-
La quantité de diiode présente dans la solution S à
l'instant t est égale à :
a) 6,0.10-4 mol
b) 1,2.10-3 mol
c) 2,4.10-3 mol
d) 6,0.10-3 mol
e) 1,2.10-2 mol
S2082- + 2I-
= I2 + 2SO42-
puis : I2 + 2S2032-= 2I-
+ S4062- .
à l'équivalence 2 n(I2) = n(S2032-)
= c'v'= 0,1*12 10-3 = 1,2 10-3 mol.
n(I2) = 6 10-4 mol dans l'échantillon soit 6 10-3
mol dans S
réponse d : correcte
- On réalise, au laboratoire, l'électrolyse d'une solution de
bromure de cuivre (II). On verse dans un tube en U, un volume V = 100
ml d'une solution de bromure de cuivre (II) de concentration C = 0,5
mol/L. On y plonge des électrodes de graphite que l'on relie à une
source de tension continue. On laisse passer un courant d'intensité I =
0,5 A pendant une durée de t = 30 minutes. On observe un dépôt
métallique sur une électrode et un dégagement gazeux sur l'autre.
Données: Couples redox : Br2/ Br-; Cu2+
/ Cu ; 1 faraday = 96500 C./mol
Quelle(s) est (sont) 1'(les) affirmation(s) exacte(s) ?
a) le dépôt métallique se produit sur l'anode
b) le dégagement gazeux se produit à la cathode
c) à la cathode se produit une réduction
d) la quantité d'électricité traversant le circuit pendant l'expérience
est égale à 0,25 Ah
e) la quantité de matière en métal déposé est égale à 0,05 mole
à la cathode réduction d'un ion, donc dépôt de métal
en général
Qté d'électricité (C) = intensité(A) * durée (s) = 0,5*30*60 = 900 C ou
900/3600 = 0,25 Ah
Cu2+ + 2e- = Cu(s) donc n(Cu) = ½ n(électrons) =
½ 900/96500 voisin 5 10-3 mol.
réponses c et d : correctes
|