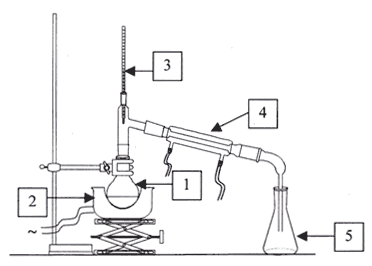
|
d'après concours aide technique laboratoire 2005 La Réunion En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
|
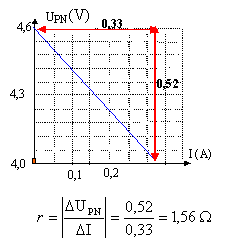
On réalise le montage suivant pour déterminer la caractéristique d'une pile de 4,5 V. 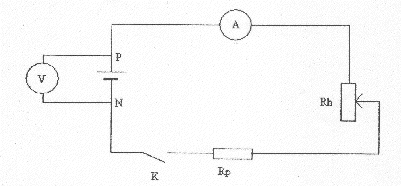
corrigé 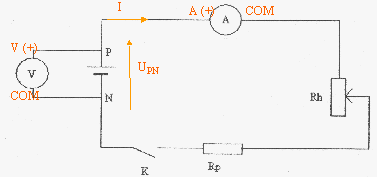
Le rhéostat permet de faire varier la valeur de l'intensité. La résistance de protection limite l'intensité à une valeur maxi qu'il serait dangereux de dépasser. fem : ordonnée à l'origine soit E = 4,63 V ; résistance interne : valeur absolue du coefficient directeur de la droite.
UPN = 4,62 - 1,56 I si UPN= 4,32 V alors I= (4,62-4,32) / 1,56 = 0,19 A Puissance fournie par le générateur UPN I = 4,32*0,19 = 0,82 W. Puissance chimique transformée : E I = 4,63*0,19 = 0,88 W Puissance joule dissippée dans le générateur : rI² = 1,56*0,19²= 0,06 W La puissance disponible aux bornes du générateur dépend : - des caractéristiques du générateur car la tension UPN dépend de la résistance interne et de l'intensité du courant - et des récepteurs car l'intensité du courant dépend des caractéristiques des récepteurs et de la résistance interne de la pile.
|
||||||||||||||||||||||||||||||||||||
|
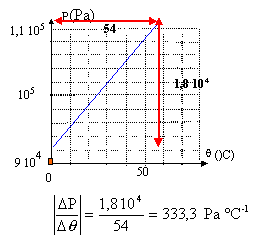
Loi des gaz parfaits : des élèves
réalisent le TP dont le mode opératoire est le suivant :
corrigé 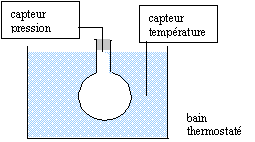
Ballon, bouchon, cristallisoir, système de chauffage de l'eau, capteurs de pression et de température. volume du ballon et quantité de matière (mol) d'air restent constantes au cours de l'expérience
fonction linéaire : P et q sont proportionnelles : P= aq + b = 333,3q + b Comment trouver b ? à partir d'une valeur du tableau : b = P-333,3q =93 000-333,3*2 =92 333 Pa. Comment retrouver une valeur approchée de la température absolue 0 K? La pession du gaz parfait est nulle à la température absolue 0 K soit 0 =333,3q + b ; q = -92333/333,3 = -277 °C. PV = nRT. P : pression en pascal ; V : volume en m3 ; n quantité de matière en mol ; T température en kelvin ; R= 8,31 J K-1 mol-1. n = PV / (RT) avec P= 9,3 104 Pa ; V= 2,5 10-4 m3 ; T= 273+2 = 275 K n= 9,3 104*2,5 10-4 / ( 8,31*275)=0,01 mol
|
|||||||||||||||||||||||||||||||||||||
|
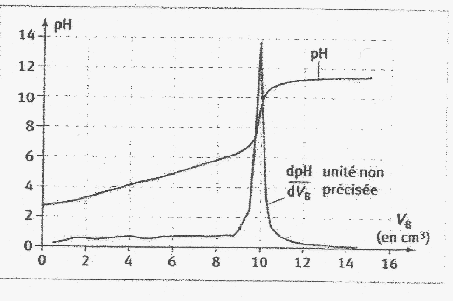
Pour réaliser le dosage d'acide citrique dans un jus de
citron on étudie deux solutions: On utilise ces deux solutions pour doser 15 mL de solution basique d'hydroxyde de sodium que l'on place, pour chaque dosage, dans un bécher avec de la pjhénolphtaléine. Il faut verser VS= 14 mL pour la solution S pour doser la solution basique et VS' = 21 mL de la solution S'.
corrigé but d'un dosage : déterminer la concentration inconnue d'une solution en utilisant une transformation chimique (acide base ou redox) et le changement de couleur d'un indicateur coloré. L'équivalence aciddo-basique est repérée par le changement de couleur de la phénolphtaléine volume d'hydroxyde de sodium : 15 mL A l'équivalence, les quantité de matière des réactifs sont en quantité stoéchiométriques n ( NaOH) = n (acide solution S) = n (acide solution S') Quantité de matière acide (mol) = volume acide (L) * concentration (mol/L) CS' VS' = CS VS orVS' >VS doncCS'<CS 1 g/L en acide citrique dans S donc moins de 1g/L d'acide citrique dans S'. masse d'acide dans VS= 14 mL : 1*14/1000 = 0,014 g. masse d'acide citrique contenue dans S' : CS' 21 = 1*14 ; CS' = 14/21 =0,67 g/L Le jus de citron est 10 fois plus concentré soit 6,7 g/L ou 6,7 10-2 g d'acide citrique dans 10 mL de jus de citron. 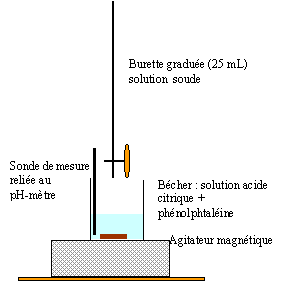
H3A + 3 HO- = A3- + 3H2O La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( 8,5 dans ce cas) : la phénolphtaléine convient ainsi que le rouge de crésol dont la zone de virage est [7,2 ; 8,8] .
|
|||||||||||||||||||||||||||||||||||||
|
L'eugénol, extrait de l'huile essentielle des clous de girofle ou des feuilles du giroflier est utilisée dans certains produits des domaines médical et dentaire en raison de ces propriétés antalgique et antiseptique. L'huile essentielle des clous de girofle contient essentiellement de l'eugénol ( 75 à 85 %), de l'acétate d'eugénol ( 4 à 10 %), du b-caryophyllène ( 7 à 10 %) et de faible quantités d'autres produits dont un peu de vanilline. Eugénol : C10H12O2 ; masse molaire : 168 g/mol ; Tébullition = 253 °C ; Tfusion = 110 °C ; densité d= 1,06 ; liquide incolore brunissant à l'air. 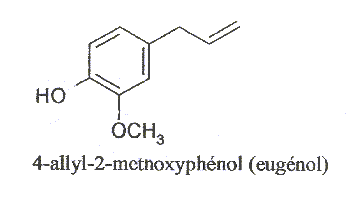
corrigé groupes fonctionnels présents dans l'eugénol. : phénol OH, ether -O-CH3, double liaison C=C des alcènes. état physique où se trouve l'eugénol à température ambiante et sous pression atmosphérique : solide
1 : ballon ; 2 : chauffe ballon ; 3 : thermomètre; 4 réfrigérant ; 5 : erlenmeyer extraction par entraînement à la vapeur d'eau de molécules organiques comme l'eugénol. extraction par solvant : les deux solvants ne doivent pas être miscibles, avoir des densité différentes et l'eugénol doit être peu soluble dans l'eau et très soluble dans l'autre solvant ( dichlorométhane) dans une ampoule à décanter introduire l'huile essentielle contenant l'eugénol puis quelques mL de dichlorométhane agiter, dégazer, laisser décanter. Le liquide le plus dense, le dichlorométhane contenant l'eugénol occupe la partie inférieure. Le sulfate de magnésium anhydre est un désséchant, il élimine les trace d'eau.
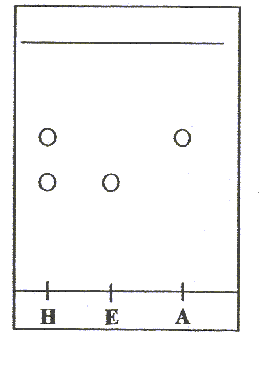
CCM : chromatographie sur couche mince la chromatographie permet de séparer et d'identifier les constituants d'un mélange en utilisant la différence de solubilité d'un produit entre une phase fixe et une phase mobile, l'éluant. La révélation est nécessaire, chaque fois que les produits ou réactifs sont incolores. L'huile essentielle obtenue par hydrodistillation contient : E : eugénol du commerce et A : acéthyleugénol du commerce.
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||