|
abaisser le pH de l'eau d'une piscine ; acide lactique ; acide et conductimétrie ; hélianthine En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
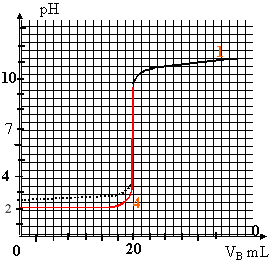
La mise en solution dans l'eau du fluorure d'hydrogène HF et du chlorure d'hydrogène HCl conduit à des solutions acides, respectivement l'acide fluorhydrique et l'acide chlorhydrique. Un logiciel a réalisé la simulation du dosage de VA = 20 mL d'acide fluorhydrique de concentration CA par une solution d'hydroxyde de sodium de concentration CB = 1,0 x 10-2 mol.L-1. Ce logiciel utilisé a permis la représentation simultanée : - des variations du pH en fonction du volume de soude versé VB (courbe 1), - des variations des concentrations molaires [HF(aq)] et [F-(aq)] (en mmol.L-1) en fonction du volume VB (courbes 2 et 3 non identifiées). Données : Produit ionique de l'eau : Ke = [H3O+(aq)] [HO-(aq)] = 1,0 10-14
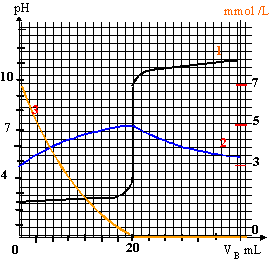
Lors du titrage, il y a transfert d'un proton de l'acide HF vers la base HO- : HF + HO- = F- + H2O La concentration [HF] diminue puis s'annule àprès l'équivalence du titrage : donc courbe (3) La concentration [F-] augmente jusqu'à l'équivalence puis diminue ensuite du fait de la dilution : courbe 2. Concentrations [HF(aq)]0 = 7 mmol/L et [F-(aq)]0 = 3 mmol/L ( lecture courbes 2 et 3) Concentration molaire apportée CA
de l'acide = [HF(aq)]0 + [F-(aq)]0
= 10 mmol/L HF(aq) + H2O = H3O+(aq)
+ F-(aq)
HF + HO- = F- + H2O Les coordonnées du point d'équivalence E :(VE
= 20 mL ; pHE= 7 ) à l'équivalence les quantités de matière d'acide et de base sont en proportions stoéchiométriques CA VA = CB VE soit CA = CB
VE / VA = 0,01*20/20 =
0,01 mol/L. HF(aq) + H2O = H3O+(aq) + Cl-(aq) réaction totale donc [ H3O+]= CA = 0,01 mol/L et pH= -log [ H3O+] = - log 0,01 = 2 L'équation de la réaction de titrage : les couple en présence sont : H3O+ / H2O et H2O/ HO-. il y a transfert d'un proton de l'acide H3O+ vers la base HO- : H3O+ + HO-= 2H2O
|
|||||||||||||||||||||||||
|
Pour abaisser le pH des eaux d'une piscine, on peut utiliser une poudre appelée pH moins qui contient 17,8% en masse de bisulfate de sodium, ou hydrogénosulfate de sodium NaHSO4. On considère que les propriétés acido-basiques de cette poudre sont dues uniquement à la présence d'ions hydrogénosulfate HSO4-.
corrigé couples acide base : HSO4- / SO42- ; H3O+ / H2O. HSO4- + H2O = H3O+ + SO42- masse de NaHSO4 contenu dans 500 g de poudre : 500*0,178 = 89 g masse molaire NaHSO4 : 23 +1 +32 + 4*16 = 120 g/mol Qté de matière (mol) = masse (g) / masse molaire (g/mol)= 89/120 = 0,742 mol NaHSO4 constitue le réactif limittant : (l'eau est en grand excès) 0,742 mol de NaHSO4 disparaissent et il se forme 0,742 mol H3O+ et 0,742 mol SO42- concentration (mol/L) = Qté de matière (mol) / volume de la piscine (L) [HSO4- ]fin = 0 ; [H3O+]fin =[SO42-]fin =[Na+]fin =0,742 / 5 104 = 1,48 10-5 mol/L
|
||||||||||||||||||||||||||
|
Par fermentation le lactose est transformé en acide lactique CH3-CHOH-COOH responsable de l'acidité du lait.On veut déterminer la concentration c d'un lait en acide lactique. On dose l'acide lactique par une solution de soude.
corrigé Le facteur de dilution est égal à deux. Prélever 50 mL de solution mère à l'aide d'une pipette jaugée. Placer dans la fiole jaugée de 100 mL et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène. couples acide base : H2O/HO- ; CH3-CHOH-COOH / CH3-CHOH-COO-. CH3-CHOH-COOH + HO- =CH3-CHOH-COO- + H2O A l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques CbVéqui= CaVa soit Ca =CbVéqui/Va C1 = 0,01*3/20 = 1,50 10-3 mol/L C2= 0,01*3,1/20 = 1,55 10-3 mol/L écart relatif : (1,55-1,50) / 1,55=3,2 10-2 ou 3,2 %. |
||||||||||||||||||||||||||
|
On dispose de deux solutions aqueuses S1 et S2 de même conductivité s. S1 est une solution de chlorure d' éthylammonium ( C2H5NH3+ + Cl-) de concentration c1. S2 est une solution d' hydroxyde de sodium ( Na+ + HO-) de concentration c2.
Données: l (C2H5NH3+ )= 4,05 10-3 S.m².mol-1 ; l (Na+)= 5,00 10-3 S.m².mol-1 ; l (Cl-)= 7,63 10-3 S.m².mol-1 l (HO-)= 19,8 10-3 S.m².mol-1. corrigé conductivité de S1 : s 1 = [ l (C2H5NH3+ )+l (Cl-) ]c1 = (4,05+7,63) 10-3 c1=11,68 10-3 c1. conductivité de S2 : s 2 = [ l (Na+) +l (HO-) ]c2 = (5+19,8) 10-3 c2=24,8 10-3 c2. or s 1 = s 2 donc c2< c1. 11,68 10-3 c1 = 24,8 10-3 c2 soit c1 =24,8/11,68 c2 = 2,12 c2. conductivité du mélange en absence de réaction chimique : les quantités de matière de chaque ion reste constante, le volume de la solution double, donc les concentrations c1 et c2 sont divisées par 2. mélange : s 3 = [ l (C2H5NH3+ )+l (Cl-) ]½c1+[ l (Na+) +l (HO-) ]½c2 = ½s 1 + ½s 2 . or s 1 =s 2 donc s 3 = s 1 =s 2 . or la conductivité du
mélange a changé : donc l'hypothèse de l'absence de réaction chimique
est fausse.
il y a transfert de proton entre l'acide C2H5NH3+ et la baseHO-. C2H5NH3+ + HO- = C2H5NH2 + H2O. Les quantités de matière des réactifs diminuent et les produits sont des molécules, n'intervenant pas dans l'expression de la conductivité. En conséquence la conductivité va diminuer car il y a moins d'ions en solution après réaction.
[C2H5NH3+]fin =(c1-c2)v / (2v) = ½ (c1-c2) [Na+]fin =c2 v/(2v) = ½c2 ; [Cl-]fin =c1 v/(2v) = ½c1 ; conductivité du mélange s 3 = l (C2H5NH3+ )[C2H5NH3+]fin+ l (Cl-)[Cl-]fin + l (Na+) [Na+]fin s 3 =½[ l (C2H5NH3+ )(c1-c2) + l (Cl-) c1 +l (Na+)c2] s 3 =½ 10-3 [ 4,05 (c1-c2) + 7,63 c1 +5c2] |
||||||||||||||||||||||||||
|
L'hélianthine est un colorant qui présente la propriété de changer de couleur en fonction du pH de la solution dans laquelle il se trouve. Sa synthèse fait intervenir 5,0 g d'acide sulfanilique C6H7NO3S et 0,033 mol de diméthylaniline C8H11N, l'autre réactif (NaNO2) étant en excés. Elle permet d'obtenir 7,0 g d'hélianthine C14H14N3SO3Na.
Données : Masse volumique de l'eau : 1,00g.cm-3 Masses molaires (g/mol): C:12 ; H:1; N:14; N:14; O:16; S:32; Na:23 corrigé C6H7NO3S + C8H11N + NaNO2 = C14H14N3SO3Na + 2 H2O C6H7NO3S : M= 6*12+7+14+3*16+32=173 g/mol Qté matière (mol) = masse (g) / masse molaire (g/mol)= 5/173 = 0,029 mol 0,033 mol de diméthylaniline C8H11N donc en excès xmax= 0,029 mol . C14H14N3SO3Na : M= 14*12+14+3*14+32+3*16+23=327 g/mol masse : 0,029*327 = 9,4 g rendement 7/9,4 *100 = 74 %. 0,04% en masse : dans 1 L ou 1000 g il y a 4 10-4*1000=0,4 g d'hélianthine volume de solution : 7/0,4=17,5 L. Qté de matière (mol) dans 1 L) ou concentration = masse dans 1 L (g) / masse molaire (g/mol) 0,4 / 327 = 1,22 10 -3 mol/L. |
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||