A 20°C, la masse volumique de l'éthanol est égale à 0,791 g/mL et celle de l'eau à 0,998 g/mL.
Un mélange contenant 40% d'éthanol et 60% d'eau (en masse) présente une masse volumique de 0,937 g/mL.
A-t-on, après mélange, additivité des volumes initiaux de chaque constituant ?
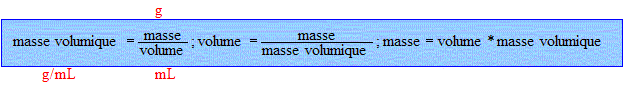
On considère 100 g de mélange eau éthanol.
masse d'alcool : g
volume d'alcool : masse d'alcool par masse volumique de l'alcool = 40 / 0,791 = 50,6 .
masse d'eau : g
volume d'eau : masse d'eau par masse volumique de l'eau = 60 / 0,998 = 60,1 mL
volume total des deux liquides avant mélange : 50,6+60,1 = 110,7 mL
Je calcule le du mélange en divisant la du mélange par la masse volumique du mélange :
100 / 0,937 = 106,7 mL
Lors du mélange il n'y a pas additivité des volumes des constituants.