On considère trois molécules: dioxyde de carbone CO2, ammoniac NH3 et sulfure d'hydrogène H2S.
1) Dans ces molécules, les liaisons sont-elles polarisées ?
2) Ces molécules sont elles polaires ?
3) Expliquer la faible solubilité du CO2 dans l'eau par rapport à celle des autres gaz.
L'atome d'oxygène, plus que l'atome de carbone attire à lui, les doublets d'électrons de liaison. Les liaisons C=O sont donc polarisées.
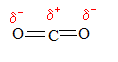
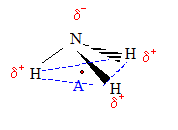
L'atome d'azote, plus électronégatif que les atomes d'hydrogène, attire à lui les doublets d'électrons de liaison. Les liaison C--H sont donc .
L'atome de , plus électronégatif que les atomes d'hydrogène, attire à lui les doublets d'électrons de liaison. Les liaison S--H sont donc polarisées.
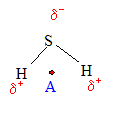
Dans la molécule d'amoniac NH3, dans la molécule d'hydrogène sulfuré H2S, le barycentre des charges positives( représenté par le point A) ne coïncide pas avec le barycentre des charges négatives ( situé respectivement sur l'azote ou le soufre): ces molécules sont donc .
Par contre, du fait de la de la molécule de CO2, le barycentre des charges positives et le barycentre des charges négatives coïncident. Les deux barycentres sont situés sur l'atome de carbone. La molécule de CO2 n'est pas polaire.
L'eau est un solvant : en conséquence les molécules polaires sont dans l'eau. Par contre les molécules non polaires, comme le dioxyde de carbone CO2, sont peu solubles dans un solvant polaire. ( Qui se ressemble, s'assemble).