|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
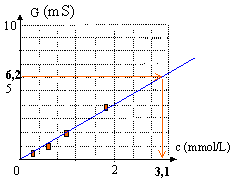
On désire déterminer la concentration molaire C d'une solution aqueuse de phosphate de magnésium, notée S. Pour cela, on prépare à 25°C, V0
= 1,00 L d'une solution notée S0, par
dissolution dans l'eau distillée de m = 2,50 g de phosphate de
magnésium anhydre de formule Mg3(PO4)2.
A partir de S0, on réalise à 25°C, quatre
solutions filles en procédant comme suit : - solution S2 :10,0 mL de S0 que l'on complète à 100,0 mL dans une fiole jaugée. - solution S3 : 25,0 mL de S0 que l'on complète à 500,0 mL dans une fiole jaugée. - solution S4 :10,0 mL de S0 que l'on complète à 500,0 mL dans une fiole jaugée. Dans les différents solutions S0, S1, S2, S3, S4 et S, on plonge tour à tour une cellule conductimétrique formée de deux plaques planes, parallèles de surface immergée s = 4,00 cm2 et séparées par une distance constante d. Les électrodes sont reliées à un GBF en mode sinusoïdal qui impose une tension U = 2,00 V constante. On mesure l'intensité I du courant qui traverse le circuit pour les différentes solutions préparées et la solution S :
Données : - Masses molaires (en g.mol-1) : M(O) = 16,0 M(Mg) = 24,3 M(P) = 31,0 - Conductivités molaires ioniques à 25°C (en S.m2.mol-1) : lMg2+ = 10,6 10-3 ; lPO43- = 20,7 10-3 ;lNa+ = 5,01 10-3 ; lHO- = 19,8 10-3 . corrigé équation de dissolution du phosphate de magnésium anhydre Mg3(PO4)2 (s) = 3Mg2+(aq) + 2PO43-(aq) Masse molaire Mg3(PO4)2 : 3*24,3 + 2(31+4*16)=262,9 g/mol Qté de matière en soluté apporté : masse (g) / masse molaire (g/mol) = 2,5 / 262,9 = 9,51 10-3 mol. concentration 'mol/L) =Qté de matière (mol) / volume de la solution (L) [Mg2+]= 3*9,51 10-3 / 1 = 2,85 10-2 mol/L = 28,5 mol m-3 [PO43-]=2*9,51 10-3 / 1 = 1,90 10-2 mol/L= 19 mol m-3 solution S1 : S0 est diluée 50/10 = 5 fois donc concentration en soluté apporté c1= 9,51 10-3/5= 1,90 10-3 mol/L solution S2 : S0 est diluée 100/10 = 10 fois donc concentration en soluté apporté c2= 9,51 10-3/10= 9,51 10-4 mol/L solution S3 : S0 est diluée 500/25 = 20 fois donc concentration en soluté apporté c2= 9,51 10-3/20= 4,76 10-4 mol/L solution S4 : S0 est diluée 500/10 = 50 fois donc concentration en soluté apporté c2= 9,51 10-3/50= 1,90 10-4 mol/L
s = 10,6 10-3*28,5 +20,7 10-3 *19 = 0,695 Sm-1. distance d qui sépare les deux plaques de la cellule conductimétrique : s = k G avec k = d (m) / s(m²) k = s /G : 0,695 / 18,5 10-3 = 37,6 m-1 ; d = ks = 37,6*4 10-4 = 1,5 10-2 m = 1,5 cm.
réaction de précipitation : Mg2+(aq) + 2HO- (aq)= Mg(OH)2 (s)
Mg2+ : 0,05*2,85 10-2 = 1,42 10-3 mol ; HO- : 0,1*0,025 = 2,5 10-3 mol si HO- en défaut : 2,5 10-3-2xmax= 0 soit xmax= 1,25 10-3 mol si Mg2+ en défaut : 1,42 10-3 -xmax = 0 soit xmax= 1,42 10-3 mol concentration finale des ions : volume du mélage =0,15 L [Mg2+ ]=1,7 10-4 /0,15 = 1,13 10-3 mol/L = 1,13 mol m-3. [Na+ ]=2,5 10-3 /0,15 =1,67 10-2 mol/L = 16,7 mol m-3. [PO43-]= 2/3[Mg2+ ]initial =2/3*1,42 10-3 / 0,15 = 6,31 10-3 mol/L=6,31 mol m-3. conductivité de la solution : s = lMg2+ [Mg2+ ] +lPO43-[PO43-]+lNa+ [Na+ ] s = 10,6 10-3 *1,13 ++ 20,7 10-3 *6,31 + 5,01 10-3*16,7 = 0,227 S m-1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On désire réaliser un capteur permettant de mesurer le niveau d'une solution électrolytique contenue dans un récipient. Pour cela, on utilise 2 électrodes rectangulaires et parallèles, posées verticalement dans le récipient. Les électrodes ont une hauteur h=1,0 m, une largeur de l =10 cm et sont distantes de L=10 cm. La solution contenue dans le récipient a une conductivité s =1,2 S m-1.
corrigé section S de solution électrolytique comprise entre les deux électrodes : S= H l avec h et l = 10 cm = 0,1 m et S en m² intensité I = G U avec I en ampère, G en siemens et U en volt. La conductance G (S) et la conductivité s (S m-1) sont proportionnelles : G= k s avec k constante de cellule (m) k = section /distance L des électrodes : k = S/L avec S en m² et L =10 cm = 0,1 m k=S/L=S/0,1 = H l / 0,1 = H*0,1/0,1 = H mètre G = k s = Hs =H*1,2 = 1,2 H siemens I= G U avec U= 1 V soit I = G = 1,2 H. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On dispose de 20 mL d'une solution S1 de nitrate d'argent(Ag+ +NO3-) de concentration 1,00.10 -3 mol/ L. La conductance d'une portion de cette solution est G1=5,93.10-4 S. On dispose également de 80,0 mL d'une solution S2 d'iodure de sodium Na+ + I- dont la concentration est 1,00.10 -3 mol/ L. La conductance d'une portion de cette solution est G2=5,65.10-4 S. Lors du mélange de ces deux solutions ,on observe l'apparitiond'un précipité jaune d'iodure d'argent AgI. L'équation de la réaction est Ag+(aq) +I-(aq)-->AgI(s). lNa+ = 5 10-3 ; lI- = 7,68 10-3; lNO3- = 7,14 10-3 S m2 mol-1. A la température de l'expérience, la conductivité d'une solution de chlorure de potassium de concentration c=10,0 mol.m-3 vaut 0,141 S.m-1. En plongeant la cellule utilisée pour toutes les expériences éffectuées dans la solution précédente ,on obtient une conductance G =6,41.10-3 S.
corrigé Qté de matière initiale de tous les ions présents en solution : volume (L) * concentration (mol/L nAg+ = nNO3- = 0,02*10-3 = 2 10-5 mol nNa+ = nI- = 0,08*10-3 = 8 10-5 mol
[I-]fin = 6 10-5 / 0,1 = 6 10-4 mol/L = 0,6 mol m-3. [NO3-]fin = 2 10-5 / 0,1 = 2 10-4 mol/L = 0,2 mol m-3. [Na+]fin = 8 10-5 / 0,1 = 8 10-4 mol/L = 0,8 mol m-3. sfin = lNa+ [Na+]fin +lI- [I-]fin +lNO3- [NO3-]fin sfin = lNa+ *0,8 + lI- *0,6 + lNO3- *0,2 sfin =5 10-3 *0,8 + 7,68 10-3*0,6 + 7,14 10-3 *0,2 = (4 + 4,6 +1,43)10-3 = 1,03 10-2 Sm-1. constante de cellule : conductance G (S) et conductivité s (S m-1)sont proportionnelles G= k s avec k en m. k= G/s = 6,41.10-3 / 0,141 = 0,045 m. en conséquence Gfin = k sfin =0,045*1,03 10-2 = 4,68 10-4 S. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|