|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
|
On se propose de déterminer les masses en ions chlorure et en acide lactique présents dans un lait. I- Dosage par conductimétrie :
II- Dosage de l'acide lactique : Un lait frais ne contient pas d'acide lactique. En vieillissant, le lactose présent dans le lait se transforme en acide lactique, noté par la suite HA. On dose l'acide lactique, considéré comme le seul acide présent dans le lait étudié, par une solution d'hydroxyde de sodium : Na+(aq) + HO-(aq) (soude) de concentration CB = 5,00 10-2 mol.L-1. On prélève un volume VA = 20,0 mL de lait que l'on place dans un bécher et on suit l'évolution du pH en fonction du volume VB de soude versé.
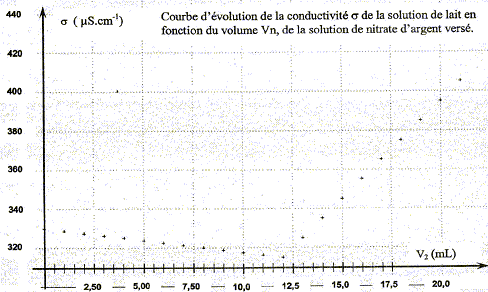
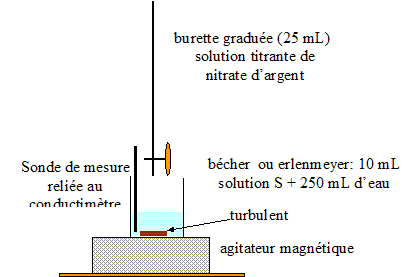
Dosage par conductimétrie : On prélève un volume V0 = 20,0 mL de lait (solution S0) et on les introduit dans une fiole jaugée de volume VS = 100,0 mL : le facteur de dilution F est égal à : F= VS /V0 = 100/20 = 5. De plus F= C0 /CS d'où : C0 =5CS. prélever V1 = 10,0 mL de la solution S : verser un peu de solution S dans un bécher, prendre une pipette jaugée de 10,0 mL ( rincée avec la solution S) surmontée d'un pipeteur ; utiliser un autre bécher pour placer ce prélevement. schéma annoté du dispositif expérimental de suivi conductimétrique :
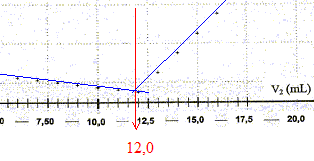
La conductivité initiale de la solution est due à tous les ions qu'elle contient et en particulier à l'ion chlorure. variation de la valeur de la conductivité s du milieu réactionnel au cours du dosage : avant l'équivalence, les ions chlorure sont en excès, les ions argent ajoutés sont tous consommés ; on ajoute des ions nitrate d'où l'expression de la conductivité s du milieu réactionnel : s = lCl- [Cl-] + lNO3- [NO3-]. Du point de vue de la conductivité, tout se passe comme si on remplaçait les ions chlorure par les ions nitrate ; de plus le volume de la solution est à peu près constant : or lNO3- <lCl- , en conséquence la conductivité va diminuer. après l'équivalence, les ions chlorure ont disparu, les ions argent ajoutés ne sont plus consommés ; on ajoute des ions nitrate d'où l'expression de la conductivité s du milieu réactionnel : s = lAg+ [Ag+] + lNO3- [NO3-]. Les concentrations de ces deux ions croissent et en conséquence la conductivité va augmenter. L'abscisse du point particulier, intersection des deux segments de droites, apparaissant sur la courbe s = f(V2) , donne le volume de solution titrante ajouté à l'équivalence. V2E =12,0 mL
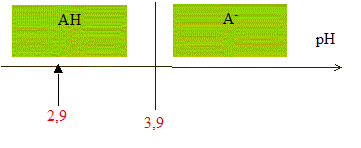
D'après les coefficients stoechiométriques de l'équation de réaction : Ag+(aq) +Cl-(aq) = AgCl(s), à l'équivalence la quantité de matière en ions argent introduits est égale à la quantité de matière en ions chlorure initialement présents. C2V2E =V1CS d'où CS =C2V2E /V1 = 5,00 10-3 * 12,0 / 10,0 = 6,00 10-3 mol/L en tenant compte de la dilution, C0 = 5 CS =3,00 10-2 mol/L. Masse d'ions chlorure présents dans 1 L de lait étudié : CS *M(Cl-) = 3,00 10-2 *35,5 =1,07 g/L. La masse d'ions chlorure présents dans un litre de lait doit être comprise entre 1,0 g et 2,0 g : ce lait correspond donc à cette norme. Dosage de l'acide lactique : Equation de la réaction qui se produit lors du mélange : HA + HO- = A- + H2O Une réaction adaptée à un dosage doit être totale et rapide. Expression de la constante de réaction K correspondante : K= [A- ]/([HA][HO- ]) ( 1) de plus AH + H2O = A- + H3O+ avec Ka3 = [A- ][H3O+]/[AH] soit [A- ] / [AH] = Ka3 /[H3O+] repport dans (1) : K=Ka3 /([H3O+][HO- ]) = Ka3 / Ka1 = 10-3,9 / 10-14 = 1010,1. Je conclus : K étant très grand, [HA]éq , figurant au dénominateur dans l'expression de K, est très faible : la réaction est donc bien totale. Utiliser un diagramme de prédominance :
pH début < pKa3 donc l'espèce chimique prédominante au début du dosage est AH. HA(aq) et A-(aq) sont présents en quantités égales lorsque pH = pKa3 c'est à dire à la demi-équivalence de ce dosage ( V=½VB= 6 mL) quantité de matière d'acide lactique présente dans le volume VA de lait : à l'équivalence, les quantités de matière de réactifs mis en présence sont en proportions stoechiomètriques : VACA= VBCB soit CA= VBCB / VA = 12,0*5,00 10-2 / 20,0 = 3,00 10-2 mol/L. soit 3,00 10-2 / 50 = 6,00 10-4 mol AH dans 20 mL de lait. Masse d'acide lactique présente dans un litre de lait : M(HA) CA= 90* 0,0300 = 2,7 g/L. On considère qu'un lait frais a une concentration en acide lactique inférieure à 1,8 g.L-1 ; la valeur trouvée, 2,7 g/L étant supérieure à 1,8 g/L, ce lait n'est donc pas frais.
|
|||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||
|
|