|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
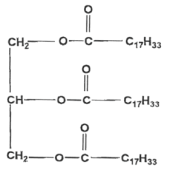
Étude de la fabrication d'un savon : Les premiers savons dits " durs " ont été élaborés dans le Nord de l'actuelle Syrie au VIIIème siècle (Un savon est mou si l'on utilise de la potasse, dur si on emploie de la soude). Le savon d'Alep est obtenu par traitement à chaud d'huile d'olive par l'hydroxyde de sodium. Le processus chimique qui aboutit au savon peut se formuler ainsi : huile d'olive + soude = savon + glycérol Les deux produits de la réaction sont séparés lors de l'opération de relargage. Fabrication " en chaudron " du savon d'Alep. La technique, pratiquée à l'ancienne, dure plus d'une semaine et comprend les quatre phases suivantes : L'empâtage : il consiste à mettre en présence l'huile d'olive et la soude caustique dans des proportions données (de telle manière que la soude soit en quantité suffisante pour saponifier complètement l'huile) et à les mélanger intimement en les faisant bouillir en présence d'eau dans une cuve. Le relargage : les deux produits sont séparés en ajoutant de l'eau salée. L'ensemble se divise en deux couches. La partie inférieure, mélangée avec de l'eau, est retirée par le fond du chaudron à travers une tubulure. La cuisson : la pâte de savon restant dans le chaudron est chauffée à ébullition pendant de nombreuses heures avec un excès de soude caustique. Les lavages : ils éliminent l'excès de soude restant dans le savon. On fait bouillir la pâte de savon avec de l'eau salée en deux ou trois lavages successifs, jusqu'à ce que le savon ne contienne plus qu'une proportion donnée de soude. Enfin, la pâte chaude du savon d'Alep est sortie de la cuve pour être étendue, sur une feuille de papier, afin qu'elle refroidisse et perde une partie de son eau. D'après un article de la compagnie générale de cosmétique
Étude de la fabrication d'un parfum :
corrigé D'après le texte, les réactifs de la saponification produisant le savon d'Alep sont : huile d'olive et hydroxyde de sodium. Formule chimique de la solution aqueuse d'hydroxyde de sodium : NaOH ( Na+(aq) + HO-(aq) ; Formule du glycérol (ou propan - 1,2,3 - triol) : C3H8O3 ou HOCH2-CHOH-CH2OH.
D'après le texte,le réactif introduit en excès lors de la saponification est la soude ou hydroxyde de sodium. Parmi les quatre techniques citées, le relargage est utilisé pour extraire le savon du milieu réactionnel. Le savon est très peu soluble dans l'eau salée ; il précipite. Les ions carboxylate présents dans ce savon comportent deux parties, une partie hydrophile et une partie hydrophobe. L'ion carboxylate peut être représenté
selon le schéma suivant : - Partie hydrophile : elle présente une affinité avec l'eau, elle s'y dissout (c'est le groupe carboxylate -COO-). - Partie hydrophobe : elle "fuit" l'eau, reste en dehors de l'eau (c'est la chaîne carbonée C17H33- ). Estérification : Le savon d'Alep est parfumé à partir d'essences naturelles. Aujourd'hui, de nombreux savons sont parfumés par ajout d'un ester synthétique. On s'intéresse dans cette partie à la fabrication d'un ester dont l'odeur rappelle celle de l'abricot. Il s'agit du butanoate de pentyle de formule semi-développée : CH3-(CH2)2-CO2-(CH2)4-CH3. Les formules semi-développées et les noms respectifs de l'acide carboxylique A et de l'alcool B qui réagissent pour donner cet ester : CH3-(CH2)2-CO2H acide butanoïque HO-CH2-(CH2)3-CH3 pentan-1-ol Equation chimique de la réaction d'estérification modélisant cette transformation : CH3-(CH2)2-CO2H +
HO-CH2-(CH2)3-CH3 = CH3-(CH2)2-CO2-(CH2)4-CH3
+ H2O (1) Suivi cinétique de l'estérification : On mélange 16,0 mL de l'acide carboxylique A pur, 0,17 mol de l'alcool B et 2 mL d'une solution aqueuse d'acide sulfurique concentrée. masse d'acide (g) = volume (mL) * masse volumique (g/mL)= 16*0,96 g Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 16*0,96 / 88 = 0,17 mol. Les quantités de matière initiales des réactifs sont proportionnelles au coeficients stoechiométriques de l'équation (1) : le mélange réactionnel préparé est équimolaire. On plonge chaque ampoule dans l'eau glacée avant d'effectuer le dosage. On réalise un blocage cinétique ; la composition du mélange réactionnel n'évolue plus à basse température ( facteur cinétique). Lors de l'ajout de la solution d'hydroxyde de sodium, les ions
hydroxyde réagissent simultanément avec les deux acides présents dans
l'ampoule : à l'équivalence : n(HO-) 1 = nH3O+ à l'équivalence : n(HO-) 2 = nRCO2H(t) Quantité de matière totale d'ion hydroxyde ayant réagi à l'équivalence : cBVBE = n(HO-) 1+n(HO-) 2 ; cBVBE =nH3O+ + nRCO2H(t) nH3O+ représente la quantité de matière d'ions oxonium libérés par l'acide sulfurique. Avancement de la réaction d'estérification à ce même instant de date t :
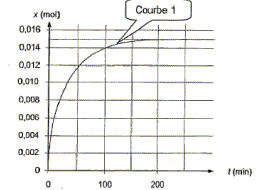
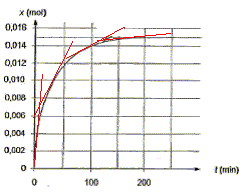
x(t) = nRCO2H(t=0) -nRCO2H(t) ; or nRCO2H(t) = cBVBE-nH3O+ d'où : x(t) = nRCO2H(t=0) - cBVBE+nH3O+ x60 = nRCO2H(t=0) - cBVBE+nH3O+ x60 = 2,3 10 -2 - 2,0*6,7 10-3+3,2 10 -3 = (23 - 13,4 + 3,2)10-3 =12,8 10-3 mol = 1,28 10-2 mol. Les dosages ayant été effectués, on trace le graphe de la variation de l'avancement x de la réaction en fonction du temps : En éliminant l'un des produis on déplace l'équilibre dans le sens direct ( loi de Le Chatelier ou loi de modération ) Proposition 2 : La vitesse volumique instantanée de la réaction augmente au cours du temps. faux. La vitesse volumique instantanée est proportionnelle au coefficient directeur de la tangente à la courbe ci-dessus à la date t. Or les tangentes se rapprochent de plus en plus de l'horizontale ; leur coefficient directeur décroît au cours du temps.
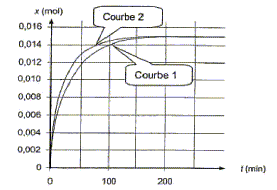
Le temps de demi réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Or le graphe indique xf= 0,015 mol ; ½xf= 0,0075 mol ; l'abscisse correspondante vaut environ 25 min. Proposition 4 : Si la température du milieu réactionnel augmente, on peut obtenir la courbe 2 suivante : vrai.
La température est un facteur cinétique ; l'équilibre est plus rapidement atteint ; sa composition ne change pas.
|
|||||||||||||||||||||||||
| |
||||||||||||||||||||||||||
|
|