|
|
||
|
||
|
sujet à paraître corrigé 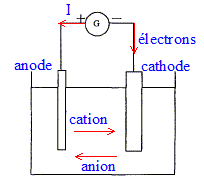
L'électrolyse est une réaction d'oxydoréduction forcée ; elle nécessite un apport d'énergie sous forme d'énergie électrique. équations des transformations aux électrodes : anode positive ( oxydation) : Cu (s) = Cu2+ + 2e-. cathode négative ( réduction) : Cu2+ + 2e- = Cu(s) bilan : Cu (s) + Cu2+ = Cu(s) + Cu2+ . anode soluble : le cuivre de l'électrode s'oxyde en ion Cu2+(aq) ; le métal de l'anode disparaît. Evolution de la concentration de la solution en ion Cu2+ : lorsqu'un ion cuivre II est réduit à la cathode, un ion cuivre II apparaît lors de l'oxydation à l'anode : en conséquence la concentration en ion cuivre II ne change pas. rôle de l'acide sulfurique : à pH supérieur à 5, on observe la précipitation de Cu(OH)2 ; le milieu doit avoir un pH inférieur à 5 : c'est le rôle de l'acide sulfurique ( d'autre part l'ion sulfate reste spectateur) la plaque d'acier doit se recouvrir de métal cuivre : elle joue le rôle de cathode ; sur cette plaque d'acier les ions cuivre II sont réduits en cuivre. Quantité d'électricité ( C) notée Q : intensité ( A) fois durée ( seconde) Q= I Dt De plus Q= ne NAe avec ne quantité de matière (mol) d'électron et e : charge élémentaire ou NAe = 1 faraday : en valeur absolue, charge d'une mole d'électrons. or à la cathode : Cu2+ + 2e- = Cu(s) d'où ne = 2 nCu. par suite : nCu = ½ne=½It / ( NAe ) masse de cuivre déposée sur l'acier : quantité de matière (mol) de cuivre * masse molaire (g/mol) mCu=nCu M(Cu) = ½neM(Cu) = ½It M(Cu) / ( NAe ) mCu=0,5*0,4*30*60*63,5 / (6,02 1023*1,60 10-19) = 2,37 10-1 g. Dans la réalité, à la cathode d'autres espèces présentes ( H2O, ion oxonium) peuvent être réduites et concurence un peu la réduction des ions cuivre II. En conséquence la masse de cuivre déposée est inférieure à la masse théorique.
|
||
|
|