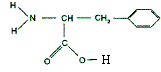|
|
||
|
||
|
On dispose d'une eau contenant du fer, uniquement sous forme d'ion ferreux Fe2+(aq) à la concentration massique t( Fe2+ ) = 270 mg/L.Cette valeur dépassant les limites fixées pour les eaux de consommation t( Fe2+ ) max= 200 mg/L, on désire diminuer la teneur en ion fer (II) en les faisant précipiter sous forme d'hydroxyde de fer (II). L'équation de la réaction chimique associée est la suivante : Fe2+(aq) + 2HO-(aq) =Fe(OH)2 (s)
corrigé Quantité de matière d'ion hydroxyde qu'il faut ajouter à 1 L de cette eau pour abaisser à la valeur t( Fe2+ ) = 150 mg/L Fe2+(aq) + 2HO-(aq) =Fe(OH)2 (s) la concentration massique en ion fer Fe2+ doit diminuer de 270-150 = 120 m g La mase d'ion Fe2+ doit diminuer de 120 m g ( 1,2 10-4 g) par litre. Quantité de matière (mol) correspondante = masse ( g) / masse molaire (g/mol) = 1,2 10-4 /55,6 = 2,16 10-6 mol. d'après les coefficients stoechiométriques de l'équation bilan : n(HO-) = 2 n(Fe2+) = 4,32 10-6 mol. Afin de ne pas modifier le volume de façon significative, on procède par l'ajout d'une dose de 10,0 mL d'une solution de soude dans 1 L de cette eau. La concentration massique de la solution de soude est : concentration molaire (mol)L) de la soude : quantité de matière (mol) /volume (L) = 4,32 10-6 /10-2 = 4,32 10-4 mol/L concentration massique ( g/L) concentration molaire (mol/L) * masse molaite (g/mol) t(NaOH) = 4,32 10-4 *40,1 =1,7 10-2 g/L.
|
||
|
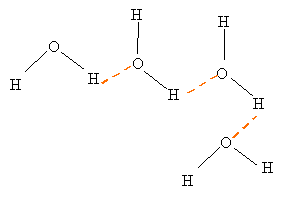
corrigé Schéma de Lewis de la molécule d'eau : 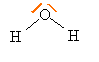
La molécule d'eau est coudée : la molécule d'eau est du type AX2E2 ( méthode VSEPR) L'atome d'oxygène étant plus électronégatif que l'atome d'hydrogène, la molécule d'eau peut être considérée comme un dipôle électrique. Lors de l'hydratation ( solvatation) d'un anion négatif, celui-ci s'entoure de molécule d'eau ( force attractive de Coulomb).
Sous une pression normale, l'eau est gazeuse au dessus de 100°C. Cette température d'ébullition est élevée comparée à celle d'autres espèces chimiques de masses molaire voisine, comme le sulfure d'hydrogène, l'ammoniac ou le méthane qui sont toutes gazeuses à des températures plus basses. Les liaisons hydrogène intermoléculaires ( pointillés rouges sur le schéma ) sont responsables de cette valeur anormalement élevée pour l'eau.
|
||
|
On place de l'eau dans une cuve en fer à l'air libre.
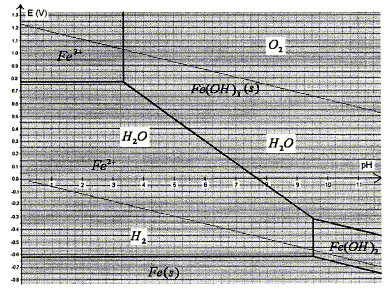
corrigé Demi-équations électroniques des couples oxydo-réducteur suivants : O2(aq)/H2O (liq) : ½O2(aq) +2e- + 2H+ = H2O (liq) (1) H2O (liq) / H2(aq) : 2H2O (liq) +2e- = H2(aq) + 2HO-(aq) (2) Fe2+(aq) / Fe (s) : Fe2+(aq)+2e- = Fe (s) (3) Fe(OH)3 (s) / Fe2+(aq) : Fe(OH)3 (s) + e- = Fe2+(aq) + 3 HO-(aq) (4) Les diagrammes potentiel -pH du fer et de l'eau sont
représentés ci-après. 2 fois (4) - (3) : Fe (s) + 2Fe(OH)3 (s) = 3 Fe2+(aq) +6 HO-(aq) (2) - (3) : Fe (s) +2H2O (liq) = H2(aq) + 2HO-(aq) +Fe2+(aq) (1) - (3) : Fe (s) +½O2(aq) + 2H+ = H2O + Fe2+(aq) Equations chimiques des réactions qui ont lieu si le pH est voisin de 3 : 2 fois (4) - (3) : Fe (s) + 2Fe3+(aq) = 3 Fe2+(aq) (2) - (3) : Fe (s) +2H2O (liq) = H2(aq) + 2HO-(aq) +Fe2+(aq) (1) - (3) : Fe (s) +½O2(aq) + 2H+ = H2O + Fe2+(aq)
On considère uniquement la réaction du dioxygène dissout sur le fer qui conduit à Fe2+(aq) : Relation liant la constante d'équilibre de cette réaction aux potentiels standard des couples mis en jeu et calcul de sa valeur à 298 K : Fe2+(aq) / Fe (s) : Fe2+(aq)+2e- = Fe (s) potentiel de Nernst : E2 = E2° + 0,03 log [Fe2+] O2(aq)/H2O (liq) : ½O2(aq) +2e- + 2H+ = H2O (liq) potentiel de Nernst : E1 = E1° + 0,03 log ([O2(aq)]½[H+]2) à l'équilibre E2 =E1 ; E2° + 0,03 log [Fe2+] =E1° + 0,03 log ([O2(aq)]½[H+]2) E1° -E2° = 0,03 log( [Fe2+] / [O2(aq)]½[H+]2 ) Fe (s) +½O2(aq) + 2H+ = H2O + Fe2+(aq) ; K= [Fe2+] / ([O2(aq)]½[H+]2) E1° -E2° = 0,03 log(K) ; log K = (E1° -E2° )/0,03 = (1,23+0,44)/0,03 = 55,7 ; K= 4,6 1055. L'ion H+ est l'un des réactifs ; mis en
excès (milieu acide), il déplace
l'équilibre dans le sens direct : cette
réaction est favorisée en milieu acide. |
||
|
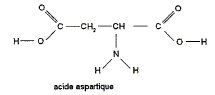
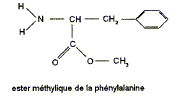
La molécule d'aspartame est un ester méthylique du dipeptide acide aspartique-phénylalanine. Sa formule semi-développée est : 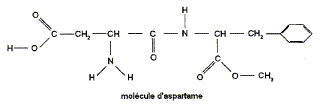
corrigé 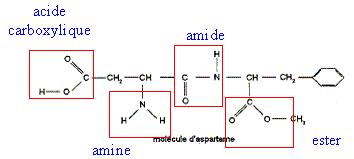
L'ester méthylique de la phénylalanine est
obtenu par une réaction
d'estérification. Les formules semi-développées des réactifs utilisés lors de cette estérification sont : le méthanol CH3-OH la
phénylalanine On obtient l'aspartame par transformation de l'ester méthylique de la phénylalanine et de l'acide aspartique dont la formule est :
|
||
|
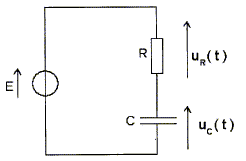
Soit le circuit électrique suivant dans lequel le
condensateur est déchargé.
corrigé Equation différentielle régissant l'évolution de uc(t) tension aux bornes du condensateur : additivité des tensions : uc+uR=E avec uR=Ri i = dq/dt et q=Cuc d'où i = Cduc/dt par suite E= uc+RCduc/dt. L'expression uc(t) = K(1-exp(-t/(RC))) est
solution de l'équation différentielle. i = Cduc/dt = K/Rexp(-t/(RC))) à t=0 : uc(t=0) = 0, le condensateur n'a pas eu le temps de se charger ; d'où uR=E = Ri(t=0) d'une part i(t=0 )= E/R et d'autre part : i(t=0
)=K/Rexp(0) = K/R ; K= E. Dans ces conditions la valeur de la constante de temps t=RC est : K/3 = K(1-exp(-0,5/t)) ; 1/3 = 1-exp(-0,5/t) ; 2/3 = exp(-0,5/t) ; ln(2/3 ) = -0,5/t ; ln(1,5 )= 0,5/t ; 0,405 =0,5/t ; t = 0,5/0,405 = 1,23 s. La valeur de C est si R= 4,7 kW : C= t / R = 1,23 / 4700 = 2,6 10-4 F.
|
||
|
|
 Préciser les formules
semi-développées des réactifs
utilisés lors de cette estérification.
Préciser les formules
semi-développées des réactifs
utilisés lors de cette estérification.