|
concours inspection des fraudes En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
| .
. |
||
|
||
|
|
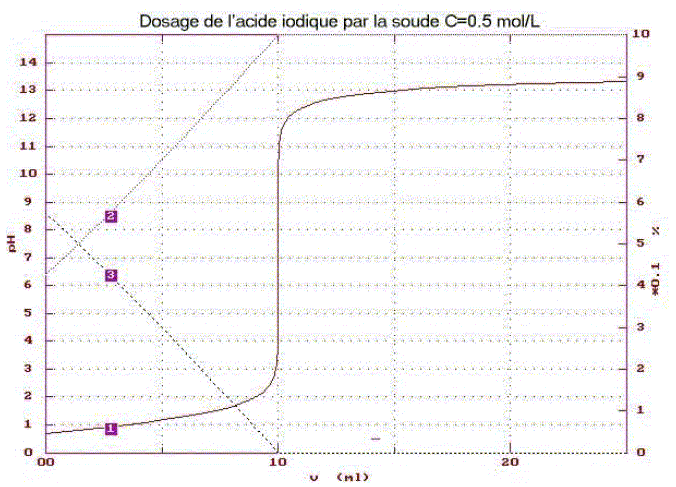
L’acide iodique HIO3 est un monoacide faible, dont la base conjuguée est l’ion iodate.
définition d’une base : espèce ion ou molécule susceptible de gagner un proton H+. ion iodate IO3-. électrode combinée de pH intégrant une sonde de température Identifier les tracés 1 ; 2; 3 : 1 : courbe du dosage pH= f(volume de soude ajouté) 3 : fraction molaire de HIO3 ; 2 : fraction molaire IO3-. L'ordonnée de l'intersection des courbes 2 et 3 donne le pH à l'équivalence : pHe = 7,5 ; l'abscisse de l'intersection de la courbe 2 avec l'axe horizontal donne le volume de soude ajouté à l'équivalence Ve= 10 mL. constante d'acidité Ka : HIO3 + H2O = IO3- + H3O+. Ka = [IO3-][H3O+] / [HIO3] Le pH à la demi-équivalence donne la valeur du pKa soit pKa = 1,2 ( lecture graphe) : Ka = 10-1,2 = 6,3 10-2. équation de la réaction du dosage : HIO3 +HO- = H2O + IO3- K= [IO3-]/([HIO3][HO-]) avec [IO3-]/[HIO3] = Ka /[H3O+] K= Ka /([H3O+][HO-]) = Ka / Ke = 6,3 10-2 / 10-14 = 6,3 1012. cette valeur étant très grande, la transformation est totale concentration Ca de l’acide iodique : à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques CaVa = Cb Ve soit Ca = Cb Ve / Va = 0,5*10 /10 = 0,500 mol/L ordre de grandeur du pHe : conservation élément iode : [IO3-]é + [HIO3]é = Ca --> [IO3-]é voisin Ca solution élecriquement neutre : [IO3-]é +[HO-]é =[ H3O+]é +[Na+]é [ H3O+]é négligeable devant [HO-]é et [Na+]é =Ca d'où [IO3-]é +[HO-]é =Ca soit [HIO3]é =[HO-]é =Ke / [ H3O+]é Or Ka = [IO3-][H3O+] / [HIO3] ; Ka =Ca[ H3O+]2é/Ke ; [ H3O+]2é=KaKe / Ca = 6,3 10-2*10-14/0,5 = 1,26 10-15 [ H3O+]é=3,5 10-8 ; pHe = 7,45.
|
|
|
|