|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
Un enfant lance vers le haut une bille de masse m=30 g. A une hauteur h=1,40 m au dessus du sol, sa vitesse est de 3m/s par rapport au sol. On néglige la résistance de l'air.
corrigé énergie mécanique = énergie cinétique + énergie potentielle de pesanteur EM= ½mv²+mgh = m(½v²+gh) = 0,03(0,5*3²+9,8*1,4)= 0,5446 ( 0,55 J) Lorsque la hauteur maximale est atteinte, l'énergie mécanique est sous forme potentielle de pesanteur ; de plus l'énergie mécanique se conserve d'où : EM= mghmax ; hmax =EM/(mg) = 0,5446/(0,03*9,8)=1,86 m La bille repasse à l'altitude h=1,4 m avec la même vitesse v = 3 m/s. écrire le théorème de l'énergie cinétique entre chaque passage à l'altitude h=1,4 m ( montée et descente) : le poids ne travaille pas , les altitudes de départ et d'arrivée sont identiques. ½mv²-½mv1²=0 d'où v=v1. vitesse au sol lors de la descente : au sol l'énergie mécanique est sous forme cinétique ; l'énergie mécanique se conserve ½mv0² = EM soit v0² = 2EM/m =0,5446*2/0,03 = 36,3 ; v0 = 6,02 ( 6,0 m/s).
|
|
|
Un noyau de bore ( 105B) peut capter un neutron pour former un noyau de lithium73Li
corrigé 105B + 10n --->AZX +73Li lois de conservation : conservation de la charge : 5 = Z+3 soit Z=2 ( élément hélium) conservation du nombre de nucléons : 10+1=A+7 soit A= 4 La seconde particule est un noyau d'hélium ou particule alpha 42He énergie libérée par la réaction d'un atome debore : Dm= m(lithium) + m(hélium) - m(bore)- m(neutron) = 7,016 + 4,0026 - 10,012 94- 1,008 67 = -0,003 u puis -0,003*1,6 10-27 = 5,027 10-30 kg E= |Dm|c² = 5,027 10-30*(3108)² =4,52 10-13 J ou 4,52 10-13 /1,6 10-19 = 2,82 106 eV= 2,82 MeV énergie libérée par la réaction complète de 1 g de bore E*NA/M(bore) = 4,52 10-13 * 6,02 1023 / 10 = 2,72 1010 J. masse d'essence : 2,72 1010 /5107 = 544 kg.
|
|
|
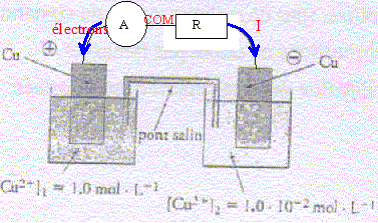
On considère une pile constituée de deux électrodes de cuivre plongeant chacune dans des solutions de sulfate de cuivre de concentrations différentes. Chaque solution a un volume de 100 mL et les concentrations initiale en ion cuivre II est [Cu2+]1=1,0 mol/L et [Cu2+]2=1,0 10-2 mol/L. 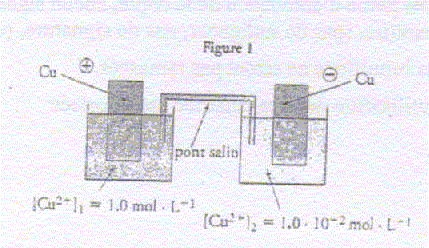
corrigé demi-équations des réactions se produisant aux électrodes : compartiment 1 : à la cathode positive, réduction : Cu2+ + 2e- = Cu ; compartiment 2 : à l'anode négative oxydation : Cu = Cu2+ + 2e- bilan : (Cu2+)1 + Cu = (Cu2+)2+Cu. quotient initial Qr i =[Cu2+]2 i / [Cu2+]1 i=0,01/1 = 0,01, valeur inférieure à K, donc évolution spontanée dans le sens direct, de la gauche vers la droite, en accord avec la polarité proposée.
concentrations finales quand l'état d'équilibre est atteint : Qr f = K = 1 = [Cu2+]2 f / [Cu2+]1 f ; [Cu2+]2 f = [Cu2+]1 f les concentrations finales sont égales. ( dans la mesure ou il y a suffisamment de cuivre métal dans le compartiment 2)
|
|
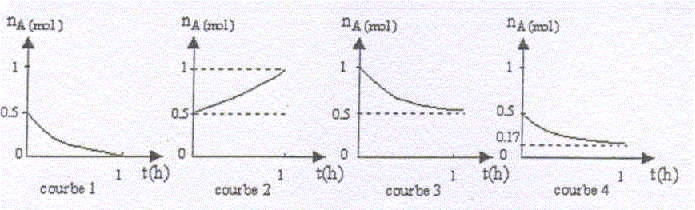
corrigé fonction chimique de ce composé : fonction ester -COO-C A : acide éthanoïque CH3-COOH ; B : (CH3)2CH-CH2-CH2OH : 3-méthylbutan-1-ol CH3-COOH + (CH3)2CH-CH2-CH2OH = CH3-COO-CH2-CH2-CH(CH3)2 + H2O estérification lente, athermique, limitée par l'hydrolyse de l'ester. Les courbes 1, 2 et 3 ne correspondent pas à l'expérience : 1 : à la fin le graphe indique nA=0, or l'estérification est limitée par l'hydrolyse de l'ester et à l'équilibre il reste de l' acide. 2 : le graphe indique une augmentation de nA; or la quantité de matière d'un réactif décroît au cours du temps. 3 : le graphe indique nA= 1 mol au départ au lieu de 0,5 mol ; de plus la réaction est limitée et la quantité finale d'acide ne peut pas être égale à 0,5 mol. rendement de la réaction ( graphe 4) quantité de matière finale d'ester / quantité théorique d'ester ( si réaction totale) *100 soit (0,5-0,17) / 0,5 *100 = 66 %. La valeur du rendement ne varie pas en prolongeant la durée du chauffage, dans la mesure ou l'équilibre est atteint. La valeur du rendement ne varie pas en augmentant la température ; l'équilibre est etteint plus rapidement. La valeur du rendement augmente en augmentant la quantité de matière du composé A ou B : l'équilibre est alors déplacé dans le sens de la consommation du réactif A ou B introduit en excès ; la quantité d'ester augmente, équilibre déplacé dans le sens direct.
|
|
|
|