|
d'après concours ENSTIM, 2005 (sans calculatrice) En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
||
| .
. |
||
|
||
|
|
Le magnésium fut isolé par Davy en 1808 et préparé sous forme solide par Bussy en 1831. Le magnésium est un concurrent de l’aluminium en raison de sa légèreté. Il est présent également dans les composés de Grignard, indispensables en synthèse organique et dans les chlorophylles qui permettent la photosynthèse. L’élément magnésium
Structure cristalline Le magnésium métal cristallise dans une structure hexagonale compacte qu’on admettra idéale.
corrigé configuration électronique de l’atome de magnésium dans son état fondamental : 1s2, 2s2 2p6, 3s2. position de l’élément magnésium dans la classification périodique : deux électrons externes, donc colonne n°2 , la 3ème couche est en partie occupée, donc 3è ligne ou période. L'atome perd
facilement deux électrons en donnant l'ion Mg2+
dont la structure électronique externe est complète.( règle de l'octet)
|
|
|
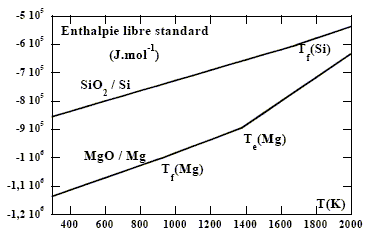
Le magnésium métal peut être obtenu selon deux procédés différents : la pyrométallurgie (réduction de l’oxyde à haute température) ou l’électrométallurgie (électrolyse du chlorure de magnésium anhydre). Obtention du métal par pyrométallurgie On s’intéresse dans cette partie à la préparation du magnésium par le procédé « Magnétherm » dans lequel l’oxyde de magnésium est réduit par le silicium. On rappelle la valeur de la constante des gaz parfaits R = 8,31 J.mol–1.K–1, les gaz sont supposés parfaits et la pression de référence est la pression standard P° = 1 bar. Afin de déterminer les conditions optimales de réduction de l’oxyde de magnésium (choix du réducteur, température, pression), on utilise un diagramme d’Ellingham.
corrigé Approximation d'Ellingham : tant qu'il n'y a pas de changement de phase, on linéarise DrG°T =DrH°298 - T Dr S°298 . On obtient des fonctions affines par intervalle. convention : écrire l'équation-bilan de la réaction d'obtention de l'oxyde à partir du corps simple en mettant en jeu une seule mole de dioxygène. couple MgO/Mg : 2Mg + O2 = 2MgO (1) couple SiO2/Si : Si+O2 = SiO2 (2) Tout métal réduit les oxydes placés au dessus de lui dans le diagramme d'Ellingham : la réduction de MgO par Si n'est pas possible dans un domaine de température où tous les constituants physico-chimiques sont solides. variance d’un système à l’équilibre contenant Si(s), SiO2 (s), MgO(s) et Mg(g) : La variance est donnée par la formule de Gibb : v = c+2-j ; c'est nombre de paramètres que peut fixer l'expérimentateur à l'équilibre du système, sans rompre l'équilibre. c = nombre de constituants - nombre d'équations chimiques indépendantes entre les constituants j : nombre de phases ; 2 facteurs intensifs, presion et température. nombre de constituants : un gaz et 3 solides non miscibles ; une relation entre les constituants :Si (s) + 2 MgO (s) = SiO2 (s) + 2 Mg (g) Dans ce cas c= 3 et j =4 (une seule phase gazeuse; trois phases solides : solides non miscibles) d'où v=1. Un seul paramètre peut être fixé par l'expérimentateur, pression ou température. expression de l’affinité chimique de cette réaction : un solide, seul dans sa phase, a une activité de 1. DrGT =DrG°T + RT ln PMg ; DrG°T = -RT ln PMg, équilibre ; DrGT = RT ln (PMg / PMg équilibre) ; A= - DrGT = RT ln ( PMg équilibre/ PMg) La réaction se produit si A est positive soit PMg équilibre> PMg.
|
||
|
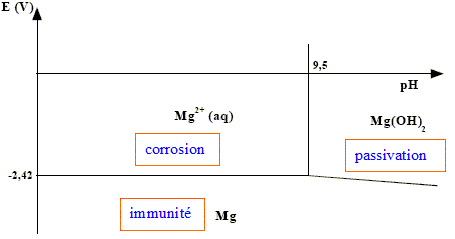
Le diagramme potentiel-pH du magnésium est tracé ci-dessous pour une concentration de travail ctr = 10–2 mol.L–1. 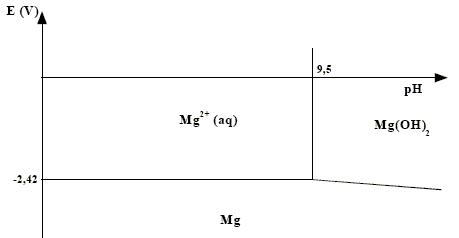
corrigé corrosion : ensemble des phénomènes par lesquels un métal ( ou un alliage) s'oxyde sous l'action d'agents oxydants. passivation : certains métaux ( aluminium , zinc ) s'oxydent très facilement au contact du dioxygène ; la couche d'oxyde métallique étant imperméable au dioxygène, le métal est alors protégé ( passivé) par cette couche d'oxyde. immunité : le métal reste stable, il ne subit pas de réaction d'oxydation.
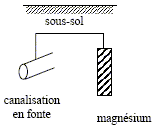
potentiel standard du couple Mg2+/Mg d’après le diagramme potentiel-pH : -2,42 V produit de solubilité Ks de l’hydroxyde de magnésium Mg(OH)2. à partir de pH = 9,5, Mg(OH)2 commence à précipiter.[H3O+]= 10-9,5 soit [HO-] = 10-4,5 mol/L Ks =[ Mg2+][HO-]2 = 10-2 * 10-9 = 10-11. ce mode de protection s'appelle protection par anode soluble ou anode sacrificielle. L’électrode de magnésium joue le rôle d'anode, le métal Mg s'oxyde et protège la canalisation en fer( rôle de cathode) Mg = Mg2+ + 2e-. Durée de vie t d’une électrode : Quantité de matière de magnésium (mol) = masse (g) / masse molaire M (g/mol) ; n = m/M Quantité de matière d'électrons : ne= 2 n = 2m/M La charge d'une mole d'électrons vaut, en valeur absolue 1 faraday ou NAe avec e : charge élémentaire Q: quantité d'électricité en coulomb ; Q= I t avec I en ampère et t en seconde. De plus Q = NAe ne= 2NAe m / M = It t = 2NAe m / (M I).
|
||
|
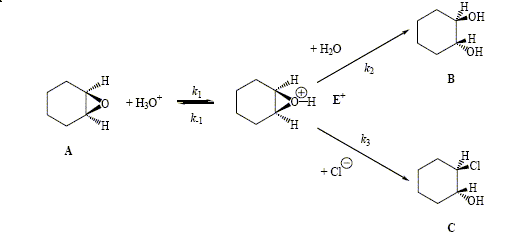
Traité par une solution aqueuse diluée d’acide chlorhydrique, l’époxycyclohexane (A) donne deux produits : le trans-2-chlorocyclohexanol (C) et le trans-cyclohexane-1,2-diol (B). 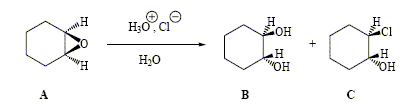
corrigé le peroxyde
|
||
|
|