On fabrique 500 ml d'une solution à partir de nitrate d'argent (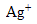 ,
, 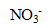 ) et de nitrate de plomb (
) et de nitrate de plomb (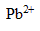 , 2
, 2 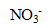 ).
).
1. Une lame de cuivre est plongée dans 250 de cette solution. On observe un dépôt métallique d'argent de masse m=5,4g.
Ecrire l'équation de la réaction d'oxydoréduction ; calculer la quantité de matière d'ions d'argent contenus dans ces 250 mL.
L'ion argent se : 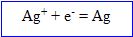
Le cuivre s' : 
Dans le bilan les électrons n'apparaissent pas : dès qu'ils sont libérés par le Cu, ils sont gagnés par les ions argent, l'
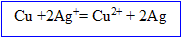
D'après les coefficients de l'équation ci-dessus, la quantité de matière d'ion argent est à celle d'argent métal.
Quantité de matière (mol) = masse (g) par la masse molaire (g/mol) = 5,4 / 108 = mol d'ion argent dans 250 mL.
2. On plonge une lame de zinc dans les autres 250 mL de la solution initiale. On observe un dépôt métallique de plomb et d'argent de masse totale m' =10,6g.
Ecrire les équations des réactions d'oxydoréduction ; calculer la quantité d'ion plomb II dans cette solution.
Le zinc s' : 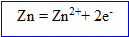
L'ion plomb II se : 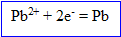
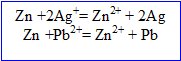
masse du dépot de plomb : 10,6-5,4 = 5,2 g
Quantité de matière (mol) = masse (g) divisée par la masse molaire (g/mol) = 5,2 / 207 = mol d'ion plomb II dans 250 mL de solution.
3. Quelles étaient les concentrations molaires initialesdes ions argent, plomb II et nitrate.
concentration (mol/L) = quantité de matière (mol) par volume de la solution (L)
[ion argent]= 0,05 /0,25 = mol/L
[ion plomb II]=0,025 /0,25 = mol/L
Quantité de matière d'ion nitrate :
0,05 mol issu du nitrate d'argent + 0,025*2 = 0,05 mol issu de la solution de nitrate de plomb
Soit au total : 0,1 mol d'ion nitrate dans 0,25 L
[ion nitrate]= 0,1/0,25 = mol/L
Données : M(Pb)=207g/mol et M(Ag)=108g/mol