On constitue la pile suivante dans laquelle les volumes des solutions valent V= 100 mL.
Sulfate de zinc : concentration en soluté apporté c= 0,10 mol/L
nitrate d'argent : concentration en soluté apporté : c' = 0,040 mol/L
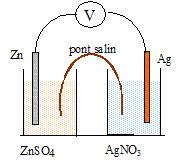
Lors du fonctionnement la masse de l'électrode d'argent augmente, tandis que la masse de l'électrode de zinc diminue.
La pile fonctionne 8,0 heures ; l'intensité du courant vaut 10 mA.
1. Indiquer sur le schéma le sen du courant, la borne positive, le sens de déplacement des porteurs de charges dans le circuit électrique et dans les solutions.
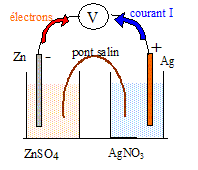
La masse d'électrode de zinc diminue : le zinc s' et libère des électrons. Le zinc constitue la borne .
Dans les solutions, les migrent vers la lame d'argent ( les ions positifs se déplacent dans le sens conventionnel du courant ), les anions migrent vers la lame de zinc.
2. Ecrire les équations des réactions qui se produisent aux électrodes et l'équation de fonctionnement de cette pile.
Le zinc s'oxyde, il libère des électrons ; le zinc constitue l' : 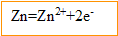
Les ions argent se réduisent et gagnent des électrons ; l'argent constitue la : 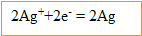
Bilan : 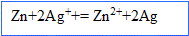
3. Exprimer le quotient de réaction initial puis calculer sa valeur. Comparer la constante d'équilibre K de la réaction de fonctionnement à ce quotient initial.

Une pile est un système évoluant de manière spontanée : donc la constante K est au quotient initial.
4. Quelles sont la quantité d'électricité mise en jeu et la masse d'argent déposé. 1F= 96500 C et M(Ag) = 108 g/mol)
Quantité d'électricité (C) = intensité (A) durée (s)
Q= 0,010 *8* 3600 = 288 C
Quantité de matière d'électrons (mol) =288 / 96500 = 2,98 10^ -3 mol
Quantité de matière d'argent déposé : 2,98 10^ -3 mol
Masse d'argent déposé (g) = quantité de matière d'argent (mol) masse molaire de l'argent (g/mol)
m = 2,98 10^ -3 * 108 = 0,32 g = mg.
5. Quelle est la concentration finale en ion zinc II ?
A une mole de zinc ( ou bien d'ion zinc II) correspond deux moles d'électrons.
Quantité de matière d'ion zinc II apparu = quantité de matière d'électrons (mol) par deux= 2,98 10^-3 / 2 = 1,49 10^-3 mol
Quantité de matière initiale d'ion zinc (mol) = volume de la solution (L) fois concentration (mol/L) = 0,1*0,1 = 0,01 mol
total : 1,15 10^-2 mol
volume de la solution : V= 0,10 L
concentration (mol/L) = quantité de matière (mol) par le volume de la solution (L) = 1,15 10^-2 / 0,1 = mol/L
6. Quelle est la capacité de la pile ( les solides constituant les masse des électrodes sont en excès) ?
La pile s'arrête de fonctionner lorsque l'un au moins des réactifs a disparu. ( ou bien lorsque le quotient de réaction devient égal à la constante d'équilibre) .
Les ions argent disparaissent : ils constituent le réactif limitant.
Quantité de matière d'ion argent :(mol) = volume de la solution (L) fois concentration des ions argent (mol) = 0,1*0,04 = 0,004 mol
Quantité de matière d'électrons correspondante : 0,004 mol
Quantité d'électricité (C) = 0,004*96500 = 386 C
durée de fonctionnement : 386 /0,010 = 38600 secondes soit environ 11 heures.