|
Agrégation physique chimie ( concours 2006 ) : mesure expérimentale d'une enthalpie de réaction. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
Cette réaction très lente est catalysée par les ions Fe3+. Dans un calorimètre de capacité thermique c'= 5 JK-1, on place V= 50,0 mL d'une solution d'eau oxygénée à la concentration c0=0,921 mol/L et la température est relevée pendant 4 min sous agitation douce. A t= 5 min on ajoute V1=10,0 mL d'une solution de nitrate de fer (III) à 0,50 mol/L. La température est à nouveau relevée pendant 15 min. Le tableau suivant rassemble les résultats :
corrigé Méthode pour déterminer la capacité thermique c' du calorimètre : méthode des mélanges Placer 50 mL ( m = 0,05 kg) d'eau "froide" dans le calorimètre et relever la température q1 à l'équilibre thermique. Ajouter alors 50 mL ( m = 0,05 kg) d'eau douce prise à la température q2 . Relever la température finale qf à l'équilibre thermique. Energie gagnée par les corps froids ( calorimètre et eau "froide" ) : Q1 =( m c + c')(qf - q1 ) c= 4,18 J g-1 K-1 capacité thermique massique de l'eau Energie cédée par l'eau douce : Q2 = m c (qf - q2 ) le calorimètre constitue un système adiabatique : Q1 + Q2 = 0 ( m c + c')(qf - q1 ) + m c (qf - q2 ) = 0 ; ( m c + c')(qf - q1 ) = m c (- qf + q2 ) c' (qf - q1 )= m c (- 2qf + q2 + q1 ) ; c'= m c (- 2qf + q2 + q1 ) / (qf - q1 ) |
||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
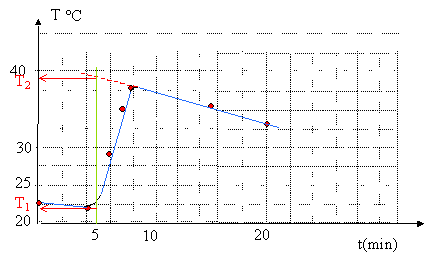
L'enthalpie de réaction est déterminée en prenant pour température initiale T1=21,9°C ( température initiale à t= 5 min ) et pour température finale T2= 38,9°C. ( cela correspondrait d'une part, à une libération d'énergie très rapide après ajout du catalyseur et d'autre part à une enceinte adiabatique ( sans échange d'énergie avec l'extérieur)) calcul de la valeur ( supposée indépendante de la température) de l'enthalpie standart de décomposition de l'eau oxygénée. Le mélange réactionnel a une masse volumique m= 1 g /mL et une capacité thermique massique c= 4,18 J g-1 K-1 Energie gagnée par le milieu réactionnel et le calorimètre : Q= ( m(V+V1) c + c')(T2-T1) Q= (1*60*4,18 +5 )(38,9-21,9) = 4349 J Quantité (mol) correspondante d'eau oxygénée : n = Vc0=0,050*0,921 = 0,046 mol Energie libérée par la décomposition de 0,046 mol d'eau oxygénée : - 4349 J Energie libérée par la décomposition d'une mole d'eau oxygénée : -4349 / 0,046 = -94,5 kJ mol-1. Calcul de la valeur théorique : H2O2(l) =H2O(l) + ½O2(g) DrH° = DfH° [ H2O(l) ] + ½DfH° [ O2(g) ] - DfH° [ H2O2(l) ] or, par définition DfH° [ O2(g) ], le dioxygène est un corps pur simple pris dans l'état standart. DrH° = -285,8 - (-191,2 ) = -94,6 kJ mol-1.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|