|
CAPES physique chimie ( concours externe 2005 ) caractère réducteur du glucose. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
Le glucose est qualifié de sucre réducteur, c'est à dire que la forme ouverte du D-glucose peut être oxydée sélectivement en acide gluconique ou en ion gluconate selon le pH de la solution. Le diagramme E-pH du glucose est proposé ci-dessous. La concentration totale maximale est égale à 1,0 10-2 mol/L. Toutes les espèces sont considérées comme solubles et il y a égalité des concentrations sur les droites frontières. 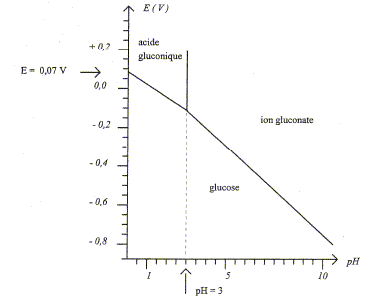
D'après le graphe ci-dessus le pKa du couple acido-basique acide gluconique/ ion gluconate vaut pKa=3 ; la forme majoritaire à pH=10, valeur supérieure au pKa, est l'ion gluconate. Test caractéristique permettant de mettre en évidence le caractère réducteur du D-glucose : en présence de
liqueur de Fehling bleue, à chaud, le glucose réduit les ions cuivre II
complexés par les ions tartrates, en oxyde de cuivre I ( Cu2O)
; on observe un précipité rouge brique.
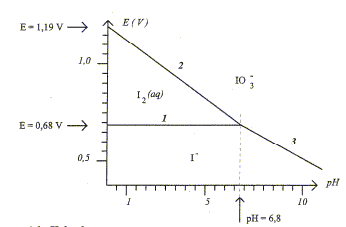
(1) couple I2(aq) / I- (aq) : 2I- = I2 + 2e-. E°(I2(aq) / I- (aq)) = 0,68 V (2) couple I2(aq) / IO3- (aq) : I2 +6H2O=2 IO3- + 12 H+ + 10e-. E°(IO3-(aq) /I2 (aq)) = 1,19 V (3) couple I- (aq) / IO3- (aq) : I- +3H2O= IO3- + 6 H+ + 6e-. Potentiel standart relatif au couple I2/I-. E1 = E°(I2(aq) / I- (aq)) + 0,03 log([I2]/[I-]2) sur la ligne
frontière (1) : [I2]=[I-]
d'où E1 = E°(I2(aq) / I-
(aq)) = 0,68 V ( lecture graphe) E3= E°(IO3-(aq) /I- (aq)) +0,01 log([IO3-][ H+]6 / [I- ]) sur la ligne frontière (3) : [IO3-] =[I- ] d'où E3= E°(IO3-(aq) /I- (aq)) + 0,01log [ H+]6 E3= E°(IO3-(aq) /I-(aq)) +0,06 log [ H+] = E°(IO3-(aq) I- (aq)) -0,06 pH à pH=6,8 : E3 = 0,68 V ( lecture graphe) 0,68= E°(IO3-(aq) /I- (aq))-0,06*6,8 ; E°(IO3-(aq)
/I- (aq))=0,68 + 0,06*6,8 = 1,09 V. Il y a dismutation en milieu basique de I2 ( espèce colorée en jaune brun) en ion iodure et en ion IO3- , espèces incolores. d'une part : 5 fois { I2 + 2e- = 2I- } réduction d'autre part : I2 + 12 HO- = 2 IO3- + 6 H2O + 10e-. oxydation 6 I2 + 12 HO- = 2 IO3- +10 I- + 6 H2O oxydo-réduction. Les espèces
majoritaires en milieu basique sont I- et IO3-
.
à pH=10 , d'après les graphes ci-dessus, les couples redox mis en présence sont : IO3- / I- : E 3voisin de 0,5 V ; ion gluconate / glucose noté RCOO- / R-CHO : E2 = -0,7 V avec R= HOCH2-CH(OH)-CH(OH)-CH(OH)-CH(OH) Le réducteur le plus fort est le glucose ; l'oxydant le plus fort est l'ion iodate IO3- . Equation bilan de la réaction : IO3- + 3H2O + 6e- = I- +6HO- ; E1= 0,5 + 0,01 log([ I- ][HO-]6/[IO3-]) 3fois { RCHO + 3HO-= RCOO- + 2e-+ 2H2O} E2=-0,7 + 0,03 log([RCOO-]/([HO-]3[RCHO])) à l'équilibre E1=E2 d'où : 0,5+0,7 = 0,01 log([RCOO-]3[ I- ]/ ([RCHO]3[HO-]3[IO3-])) 3 RCHO + 3HO- +IO3- = 3 RCOO- + I- + 3H2O avec K= [RCOO-]3[ I- ]/ ([RCHO]3[HO-]3[IO3-]) 1,2 = 0,01 log K soit K = 10120, la réaction est quantitative dans le sens direct, de la gauche vers la droite. |
|
|
|
||
|
|