|
chimie organique : dibenzylidène acétone, 4-nitroacétophénone En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
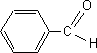
Pour synthétiser la dibenzylidène acétone ou 1,5-diphénylpenta-1,4-diène-3-one, notée X, on fait réagir le benzaldéhyde avec un composé A dont on va déterminer la structure.
la formule brute de A : CxHyOz : 12x/62,1 = 0,58 soit x= 3 ; y/10,3 = 0,58 soit y = 6 ; 16 z /27,6 = 0,58 soit z = 1 ; C3H6O. La réaction du diiode en milieu basique avec A conduit à l’apparition d’un précipité jaune. (réaction haloforme mettant en évidence le groupe -CO-CH3 d'une cétone a méthylée) CHI3 : iodoforme ou triodométhane. A est la propanone CH3-CO-CH3. CH3-CO-CH3+ 3 I2 +4 HO- --> CH3-COO-+ CHI3+3 I- + 3H2O formule semi-développée du benzaldéhyde
: C6H5-CHO formule semi-développée de Y : équations des deux réactions mises en jeu : 2 C6H5- CHO + CH3-CO-CH3 = Y puis Y = X + 2 H2O nom de la réaction de A avec le benzaldéhyde, conduisant à Y : cétolisation X existe sous plusieurs formes stéréoisomères :
|
|
|
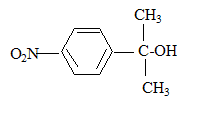
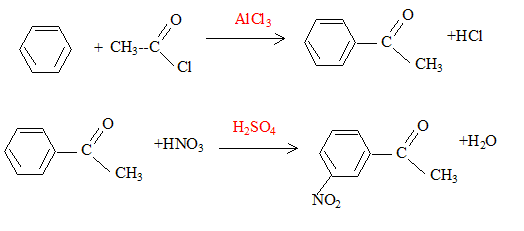
La synthèse de la 4-nitroacétophénone constitue le début de la synthèse d’un antibiotique puissant : le chloramphénicol. Malheureusement, la synthèse de la 4-nitroacétophénone est beaucoup moins directe que celle de son isomère, la 3-nitroacétophénone. 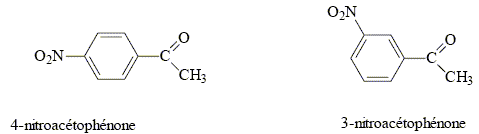
corrigé type d’isomérie existant entre ces deux molécules : isomérie de position.
L’ordre des étapes proposées n'a pas d' importance : les
deux groupes orientent en méta. équation de la réaction (1) : C6H6 + CH3Cl --> C6H5-CH3 + HCl ; le catalyseur est AlCl3. formule semi-développée et le nom du composé B : acide
4-nitrobenzoïque 5fois { R-CH3 + 2H2O = RCOOH + 6H+ + 6e-} 6MnO4- +5R-CH3
+18H+= 6Mn2+ + 5RCOOH+14H2O solvant à utiliser lors de la préparation de l’organomagnésien CH3MgBr : ether anhydre (solvant anhydre et non protique) formule semi-développée de D :
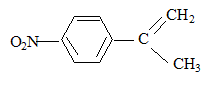
formule semi-développée de F : H2C=O ; le zinc évite l'oxydation de l'aldehyde en acide carboxylique.
|
||
|
|
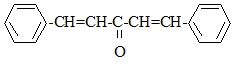
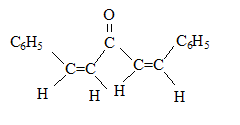 (1Z,4Z)-1,5-diphénylpenta-1,4-diène-3-one
(1Z,4Z)-1,5-diphénylpenta-1,4-diène-3-one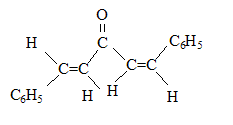 (1E,4Z)-1,5-diphénylpenta-1,4-diène-3-one
(1E,4Z)-1,5-diphénylpenta-1,4-diène-3-one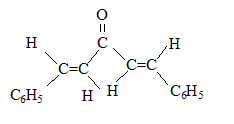 (1E,4E)-1,5-diphénylpenta-1,4-diène-3-one
(1E,4E)-1,5-diphénylpenta-1,4-diène-3-one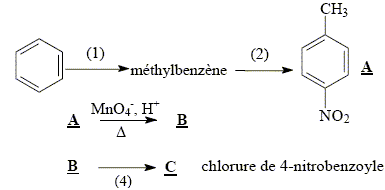
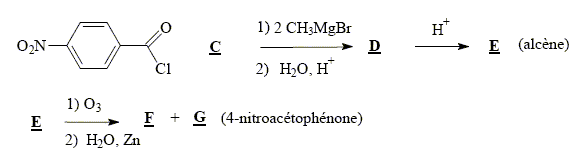
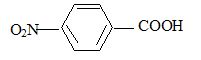 ( noté ensuite R-COOH)
( noté ensuite R-COOH)