|
Oxydo-réduction
: étude cinétique de la dismutation de l'eau
oxygénée bac
S 2007 La Réunion |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
L'eau oxygénée commerciale est une solution aqueuse de peroxyde d'hydrogène utilisée comme désinfectant pour les plaies, pour l'entretien des lentilles de contact ou comme agent de blanchiment. Le peroxyde d'hydrogène H2O2 intervient dans deux couple oxydant-réducteur : H2O2(aq) / H2O et O2 (g) /H2O2(aq) Le peroxyde d'hydrogène est capable dans certaines conditions de réagir sur lui même c'est à dire de se dismuter selon l'équation : 2H2O2(aq) =2H2O + O2(g) (1) Cette réaction est lente à température ordinaire mais sa vitesse peut être augmentée en présence d'un catalyseur. Donnée : volume molaire des gaz Vm=25 L/mol. Etude de la réaction de dismutation : Ecrire les deux demi-équations d'oxydo-réduction des couples auxquels le peroxyde d'hydrogène appartient. Etablir un tableau d'évolution du système. Détermination de la concentration initiale de la solution de peroxyde d'hydrogène : L'eau oxygénée du commerce se présente en flacon opaque afin d'éviter que la lumière favorise la transformation chimique précédente. Le flacon utilisé dans cette étude porte la mention suivante : eau oxygénée à 10 volumes. Cette indication est appelée le titre de l'eau oxygénée. Par définition le titre est le volume de dioxygène ( exprimé en litre) libéré par un litre de solution aqueuse de peroxyde d'hydrogène suivant la réaction (1) dans les conditions normales de température et de pression. On considèrera en première approximation que les conditions de l'expérience sont assimilables aux conditions normales. Avant de réaliser le suivi cinétique de la réaction de dismutation, on désire vérifier l'indication donnée sur le flacon concernant le titre de l'eau oxygénée de la solution commerciale utilisée.
Etude de la réaction de dismutation : L'oxydant H2O2(aq) se réduit en gagnant des électrons : H2O2(aq) + 2H++2e- = 2 H2O Le réducteur H2O2(aq) s'oxyde en cédant des électrons : H2O2(aq) = O2 (g) + 2H++2e-. Bilan : 2H2O2(aq) = 2 H2O + O2 (g) Tableau d'évolution du système :
Détermination de la concentration initiale de la solution de peroxyde d'hydrogène : D'après la définition du titre de l'eau oxygénée le volume de dioxygène V(O2) libéré par un volume V= 1,00 L de la solution commerciale au cours de la réaction de dismutation du peroxyde d'hydrogène est égal à l'indication portée sur le flacon . V(O2) = 10
L. n(O2) = V/Vm = 10 / 25 ;
xf = n(O2) =
0,40 mol. n0(H2O2)-2xf =0 soit n0(H2O2)=2xf = 0,80 mol dans 1 L de solution [H2O2]th = 0,80 mol/L. Détermination de la
valeur réelle de la concentration en peroxyde
d'hydrogène : L'ion permanganate est la seule espèce colorée ; il joue un double rôle: - celui de réactif ( solution titrante) se trouvant dans la burette - celui d'indicateur de fin de réaction : avant l'équivalence, dans le becher, l'ion MnO4-(aq) est en défaut, la solution est incolore. Après l'équivalence, dans le becher, l'ion MnO4-(aq) est en excès , la solution est violette. A l'équivalence on observe un changement de teinte, passage d'une solution incolore à une solution violette. Relation entre la quantité initiale de peroxyde d'hydrogène se trouvant dans le becher n0(H2O2) et la quantité d'ions permanganate introduits dans le becher à l'équivalence neq(MnO4-) :
neq(MnO4-) -2xéqui=0 donne : xéqui= ½neq(MnO4-) n0(H2O2)-5xéqui=0 donne n0(H2O2)=5xéqui=2,5 neq(MnO4-) n0(H2O2)=2,5 neq(MnO4-). neq(MnO4-) = c1 Veq=2,0 10-1 * 14,6 10-3 = 2,92 10-3 mol. n0(H2O2)= 2,5*2,92
10-3 = 7,3 10-3 mol L'écart avec la valeur théorique est proche de 10 % : l'eau oxygénée a été préparée depuis un certain temps et la dismutation du peroxyde d'hydrogène est déja bien avancée.
La dismutation est une réaction lente mais qui peut être accélérée en utilisant par exemple des ions fer (III) Fe3+(aq) présents dans une solution de chlorure de fer III, un fil de platine ou de la catalase, enzyme se trouvant dans le sang.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
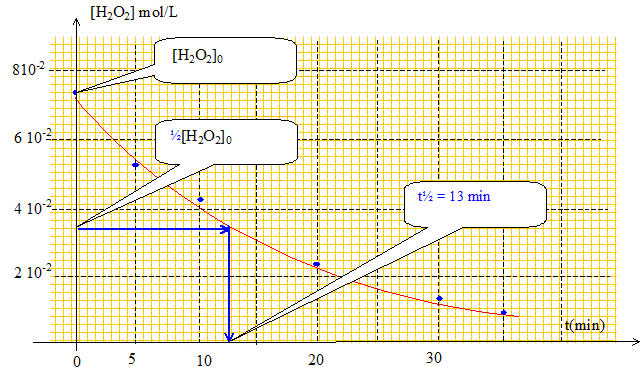
Un catalyseur est une espèce qui accélére une transformation chimique lente, mais spontanée ; il n'apparaît pas dans le bilan : il est régénéré en fin de réaction. La catalyse réalisée par un fil de platine est hétérogène : milieu réactionnel liquide et catalyseur solide. Graphe traduisant l'évolution de la concentration en peroxyde d'hydrogène en fonction du temps :
Avancement de la transformation x(t) en fonction de nt(H2O2) quantité de peroxyde d'hydrogène présent à l'instant t et de n0(H2O2) quantité initiale de peroxyde d'hydrogène :
La vitesse volumique v de la transformation chimique est définie comme étant le rapport de la dérivée de l'avancement x(t) en fonction du temps par le volume V du système : v = 1/V d x(t) / dt. n0(H2O2) étant une constante, sa dérivée est nulle d'où : d x(t) / dt =-½ d nt(H2O2) /dt v = -½ 1/V d nt(H2O2) /dt De plus [H2O2] =
nt(H2O2)
/ V d'où : v = -½
d[H2O2]/dt. -d[H2O2]/dt est le coefficient directeur de la tangente au point considéré, à la courbe ci-dessus. Or au cours du temps ces tangentes sont de moins en moins inclinées par rapport à la verticale : le coefficient directeur diminue, donc la valeur de la vitesse diminue. De plus la concentration en peroxyde d'hydrogène est un facteur cinétique : au cours du temps [H2O2] diminue et en conséquence la vitesse de la transformation diminue. Temps de demi-réaction t½ : Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. La transformation est totale donc xfin = xmax. n0(H2O2)-2xmax=0 soit xmax = ½ n0(H2O2) n0(H2O2)/ V = [H2O2]0 ; nt½(H2O2)/ V = [H2O2]t½ ; nt½(H2O2) / V =½ n0(H2O2) / V = ½[H2O2]0 A t= t½ alors [H2O2]t½ =½[H2O2]0. La température est un facteur cinétique :
si la température augmente, la vitesse de la
réaction augmente et en conséquence le temps
de demi réaction sera inférieur à la
valeur précédente.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|