|
Oxydoréduction et complexation BTS bioanalyses et contrôles 2007 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
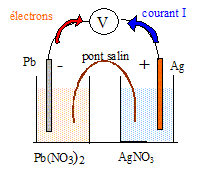
Demi pile (1) : lame de plomb plongée dans un volume V1 = 100 mL d'une solution aqueuse de nitrate de plomb ( Pb2+ + 2NO3-) de concentration molaire C1=0,100 mol/L. Demi pile (2) : lame d'argent plongée dans un volume V2 = 100 mL d'une solution aqueuse de nitrate d'argent ( Ag+ + NO3-) de concentration molaire C2=0,050 mol/L.Données : potentiels standard des couples redox à 25°C E°(Pb2+/Pb) = -0,13 V ; E°(Ag+/Ag) = 0,80 V ; Donner l'expression du potentiel d'oxydoréduction, noté E1, de la demi-pile (1) et calculer sa valeur. Pb2++2e- = Pb E1 = E°(Pb2+/Pb) +0,03 log[Pb2+] E1 = -0,13 +0,03 log 0,1 = -0,16 V. Donner l'expression du potentiel d'oxydoréduction, noté E2, de la demi-pile (2) et calculer sa valeur. Ag++e- = Ag E2 = E°(Ag+/Ag) +0,06 log[Ag+] E2 =0,80 +0,06 log 0,05 = 0,72 V. A quelle demi-pile appartient l'électrode constituant le pôle positif de la pile ? Justifier. Le potentiel de la demi-pile (2) est supérieur à celui de la demi-pile (1) : la demi pile (2) constitue le pôle positif de la pile. Faire le schéma de la pile en précisant les polarités des électrodes ainsi que le sens du courant électrique dans le circuit extérieur.
Calculer la fem E de la pile en début de fonctionnement. E = E2-E1 =
0,72-(-0,16) = 0,88
V.
Ecrire l'équation de formation de l'ion complexe Ag(NH3)2+. Ag+ + 2NH3 = Ag(NH3)2+. Calculer la nouvelle concentration , notée C'2 en ion argent Ag+ dans la demi-pile (2) à l'équilibre. E'2 = E°(Ag+/Ag) +0,06 log C'2 0,06 log C'2 = E'2 - E°(Ag+/Ag) log C'2 = [E'2 - E°(Ag+/Ag)] /0,06 = (0,45-0,72) / 0,06 = -4,5 ; C'2 =3,2 10-5 mol/L. Comparer C2 et C'2. Que peut-on dire concernant la réaction de formation de l'ion complexe Ag(NH3)2+. C2/C'2 = 0,05 / 3,2 10-5= 1600. La réaction de formation de l'ion complexe est pratiquement totale.
Etablir à l'aide d'un tableau d'évolution le bilan molaire de la réaction de formation de l'ion complexe.
xfin = 5 10-3 -0,1*3,2
10-5 = 5 10-3
mol
b = [Ag(NH3)2+] / ([Ag+][NH3]2) Calculer sa valeur. b = 5 10-3 / ( 3,2 10-6 *5 10-3*5 10-3 )= 6,3 107. |
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|