|
concours kiné ( Aderf 2002) : dismutation, acide base, autocatalyse, oxydoréduction ; Markovnikov, estérification, électrolyse En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||
| .
. |
||||||||||||||||||||
|
||||||||||||||||||||
|
Une solution verte de manganate de potassium ( 2K+ + MnO42-) devient rose en milieu acide. Couples mis en jeu : MnO42-/ Mn2+ ; MnO4-/MnO42-. L'ion manganate est un oxydant qui se réduit. 4 fois { MnO42-= MnO4- + e- } L'ion manganate est un réducteur qui s'oxyde. Le bilan est la dismutation de l'ion manganate : 5MnO42- + 8H+ = Mn2+ + 4H2O + 4MnO4- . Il se forme l'ion Mn2+, quasiment incolore et l'ion permanganate violet. La teinte rose doit être due à l'ion MnO4- si la solution n'est pas trop concentrée.
|
||||||||||||||||||||
|
On dose 10 mL d'une solution aqueuse d'acide faible, de pH=3,0 par une solution d'hydroxyde de sodium de concentration c= 5,0 10-2 mol/L. Le volume équivalent vaut VE= 16 mL. Quelle est la valeur du pKa de l'acide faible étudié ? Les concentration initiale sont notées [AH]0 et [A-]0 avec [AH]0 + [A-]0 = ca. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques : 10 ca = 16 c = 16* 0,05 = 0,8 ; ca = 0,08 mol/L
pKa = -log (1,25 10-5) = 4,9.
|
||||||||||||||||||||
|
|
||||||||||||||||||||
|
Pour préparer l'éthanoate de 3- méthylbutyle noté E, on fait agir à reflux, pendant deux heures, 53,0 g d'acide carboxylique noté A et 33,0 g d'alcool B en présence de quelques gouttes d'acide sulfurique. On recueille 36,0 mL de E H : 1 ; C : 12 ; O : 16 g/mol ; mase volumique de E : 870 kg m-3.équation de cette réaction d'estérification : CH3-COOH + (CH3)2CH-CH2-CH2OH = CH3-COO-CH2-CH2-CH(CH3)2 + H2O L'acide sulfurique est le catalyseur de la réaction. rendement : M( acide) = 60 g/mol ; M( B) = 88 g/mol ; M(E) = 130 g/mol n(acide) = 53/60 =0,883 mol ; n(B) = 33/88 = 0,375 mol ( en défaut) masse théorique d'ester : 0,375*130 = 48,75 g volume théorique d'ester ( r= 0,87 g/mL) : 48,75 / 0,87 = 56,0 mL rendement : 100*36/56 = 64,3 %. Le rendement de la réaction n' a pas été amélioré en élevant la température : l'équilibre est atteint plus
rapidement sans modification de la composition de ce
dernier.
|
||||||||||||||||||||
|
On réalise l'électrolyse d'une solution d'acide sulfurique dans un électrolyseur à électrodes de cuivre. On observe un dégagement de dihydrogène de volume V= 32 mL à l'une des électrodes, tandis que l'autre, en présence d'eau, se recouvre d' un dépôt d'oxyde de cuivre. Volume molaire Vm = 24 L/mol ; les ions sulfates sont passifs ; H : 1 ; O : 16 ; Cu : 63,5 g/mol. Oxydation à l'anode positive : 2Cu + H2O = Cu2O + 2H+ + 2e-. réduction à la cathode négative : 2H+ + 2e- = H2. Bilan : 2Cu + H2O = Cu2O + H2. 2 est vrai. L'électrolyse est une réaction endoénergétique : elle consomme de l'énergie électrique. Quantité de matière H2 : V/Vm = 0,032/24 = 1,33 10-3 mol D'après les coefficients de l'équation bilan : n(Cu ) = 2 n(H2 ) = 2,67 10-3 mol Dm= 2,67 10-3 *63,5 = 0,17 g.
|
||||||||||||||||||||
|
On introduit dans un erlenmeyer 50 mL d'une solution d'eau oxygénée de concentration C inconnue puis 50 mL d'une solution acidifiée de iodure de potassium de concentration 0,20 mol/L. L'eau oxygénée est en défaut. On attend suffisamment longtemps pour que la réaction soit terminée. On dose ensuite le diiode formé par une solution
de thiosulfate de sodium de concentration 0,08 mol/L. Pour
cela on prélève 20 mL du mélange
précédent et l'on doit verser 14 mL de la
solution de thiosulfate de sodium pour obtenir
l'équivalence. couple redox : I2/I- ; S4O62- / S2O32- ; H2O2/ H2O. 2I- = I2 + 2e-. Bilan : H2O2 + 2H+ +2I- = I2 +2H2O (1) d'où n(H2O2) = n(I2). étape n° 2 : dosage du diiode formé. I2 + 2e- = 2I- 2S2O32- = S4O62- + 2e- Bilan : 2S2O32- + I2= 2I- + S4O62- (1) d'où n(I2)= ½n(S2O32-) = 0,5*0,08*14 = 0,56 mmol (1) donne : n(H2O2) = n(I2)= 0,56 mmol d'eau oxygénée dans 20 mL de mélange. Or l'erlenmeyer contient 100 mL de mélange , soit 0,56*5 = 2,8 mmol d'eau oxygénée présentes initialement dans 50 mL . [H2O2]= 2,8/50 = 0,056 mol/L.
|
||||||||||||||||||||
|
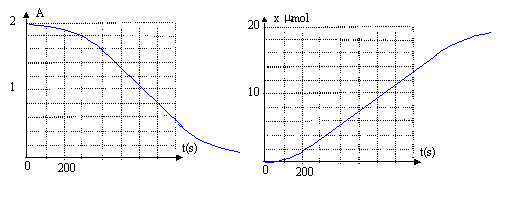
Un becher (I) contient 25 mL d'une solution d'acide oxalique H2C2O4 de concentration 0,3 mol/L et 1 mL d'acide sulfurique concentré. Un becher (II) contient 25 mL d'une solution d'acide oxalique H2C2O4 de concentration 0,3 mol/L et 1 mL d'acide sulfurique concentré et une pointe de spatuele de chlorure de manganèse (II). On verse simultanément dans chaque becher 5 mL d'une solution de permanganate de potassium à 0,02 mol/L. Dans le becher (I) la coloration violette disparaît corrigé Réaction autocatalysée par l'ion Mn2+. 2 fois { MnO4-+ 8H+ + 5e- = Mn2++ 4H2O }réduction 5 fois { H2C2O4 = 2CO2 + 2e- + 2H+ } oxydation . 2 MnO4- + 6 H+ + 5 H2C2O4 = 2 Mn2++10 CO2 + 8 H2O
L'absorbance A est proportionnelle à [MnO4- ] : la courbe [MnO4-]= f(t) présente un point d'inflexion. La vitesse de disparition de l'ion permanganate est d[MnO4-] / dt = -1 / V d(n0-2x)/dt = 2/Vdx /dt avec n0 quantité de matière initiale de MnO4-. Or dx/dt correspond au coefficient directeur de la tangente, à une date donnée, à la courbe x=f(t). D'après la courbe ci-dessus dx/dt est faible au début de la réaction ( il y a peu de catalyseur ) ; puis dx/dt croît dès que la quantité de catalyseur augmente ; enfin dx/dt diminue car la concentration des réactifs diminue au cours du temps. La vitesse de disparition de l'acide oxalique est d[H2C2O4] / dt = -1 / V d(a0-5x)/dt = 5/Vdx /dt avec a0 quantité de matière initiale de H2C2O4. La vitesse de disparition de l'acide oxalique est 2,5 fois plus grande que la vitesse de disparition de l'ion permanganate.
|
||||||||||||||||||||
|
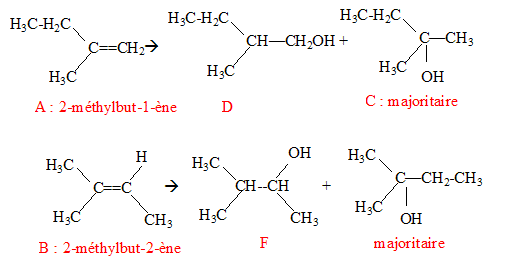
On hydrate un mélange de deux alcènes A et B en présence d'acide sulfurique dilué. L'hydratation de A donne un mélange de deux isomères C et D ( C est majoritaire) alors que l'hydratation de B donne de façon minoritaire un composé F qui est le 3-méthylbutan-2-ol. L'oxydation ménagée de D donne le 2-méthylbutanal. La règle de Markovnikov permet de prévoir sur quel atome de carbone se fixe l'hydrogène de l'hydracide ( ou de H2O) : l'atome d'hydrogène se fixe de préférence sur l'atome de carbone le moins substitué
B ne présente pas d'isomèrie Z E : l'un des atomes de carbone doublement lié porte deux groupes identiques CH3. C, alcool tertiaire, ne subit pas d'oxydation ménagée.
|
||||||||||||||||||||
|
Un bécher contient 20 mL d'une solution d'hydroxyde de potassium de concentration 0,05 mol/L. On verse progressivement une solution d'acide chlorhydrique de concentration 0,10 mol/L. On mesure le pH de la solution après chaque ajout d'acide. A 25°C on trace la courbe pH=f( V) où V est le volume d'acide ajouté. Le pH à l'équivalence est égal à 7 et la courbe pH=f(V) présente un seul point d'inflexion ( à l'équivalence). L'abscisse du point équivalent est égale à : à l'équivalence n(acide) = n(base) ; 0,1 Va= 20*0,05 soit Va= 10 mL Le pH initial est égal à : pH d'une solution de base forte :
pH= 14 + log 0,05 = 12,7.
|
||||||||||||||||||||
|
Afin de déterminer la masse m d'acide acéthylsalicylique contenu dans un comprimé d'aspirine, on réalise les expériences suivantes : Dans un ballon de 100 mL, on fait chauffer à reflux pendant 5 min, un comprimé d'aspirine avec un peu d'eau distillée et 15 mL de potasse à 1,0 mol/L. On recueille le mélange réactionnel après refroidissement dans un becher, on rince le ballon et on ajoute au becher l'eau de rinçage. On effectue le dosage de l'hydroxyde de sodium restant par une solution d'acide chlorhydrique à 0,50 mol/L. Il faut verser 7,9 mL d'acide pour obtenir l'équivalence. M( acide salicylique) = 180 g/mol ; acide salicylique : CH3-CO2-C6H4-COOH. Quelle est la valeur de la masse m ( gramme)? CH3-CO2-C6H4-COOH + 2HO- = CH3-CO2- + HO-C6H4-COO- + H2O Quantité de matière de potasse ayant réagi : n(HO-) = 2 n( aspirine) ; n( aspirine) = ½n(HO-) Quantité de matière initiale potasse : 1*15 10-3 = 0,015 mol. Quantité de matière de potasse en excès : 7,9 10-3 *0,5 =3,95 10-3 mol. d'où : 0,015-3,95 10-3 =0,011 mol de potasse ayant réagi avec laspirine. n( aspirine) = ½n(HO-) = 0,011/2 = 5,52 10-3 mol m =5,52 10-3 *180 =
0,994 g ( 1
g ).
|
||||||||||||||||||||
|
L'acide lactique est un composé organique qui ne contient que les éléments C, H et O. La combustion complète d'une masse m = 4,5 g de cet acide libère une masse m1 = 6,6 g de dioxyde de carbone et une masse m2 = 2,7 g d'eau. C : 12 ; H : 1 ; O : 16 ; acide lactique M= 90 g/mol. Quelle est la formule brute de l'acide lactique ? masse de carbone dans l'échan,tillon : 12 m1 /44 = 1,8 g soit 1,8*100/4,5 = 40 % en conséquence : 100-40-6,7 =53,3 % d'élément oxygène Formule brute de l'acide lactique : CxHyOz. 12x/ 40 = M/100 = 0,9 soit x =3 y/6,7 = 0,9 soit y = 6 ; 16z/53,3 =
0,9 soit z =3.
C3H6O3
|
||||||||||||||||||||
|
|