|
Concours Kiné : étude d'une cinétique par spectrophotométrie 2007 ( Ceerrf) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
Question 2 : 10 pts/20 sans calculatrice
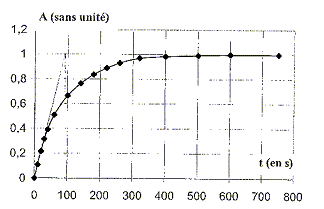
H2O2(aq) + 2 I-(aq) + 2 H+(aq) = I2(aq) + 2H2O (l) A l'instant t=0 on mélange V1= 10,0 mL d'une solution aqueuse d'iodure de potassium K+ + I- de concentration molaire c1=4,0 10-2 mol/L ( acicifiée avec de l'acide sulfurique) et V2=10,0 mL d'une solution aqueuse d'eau oxygénée de concentration molaire c2 = 3,0 10-2 mol/L. On verse une petite quantité de ce mélange réactionnel dans une cuve, qu'on place dans un spectrophotomètre réglé sur la longueur d'onde l=400 nm. A divers instants t, on relève la valeur de l'absorbance A de la solution. On obtient le graphe ci-dessous :
L'absorbance A a pour expression A= k[I2] avec k= 100 L mol-1.
Quantités de matière d'ion iodure et d'eau oxygénée présents dans le mélange réactionnel à l'instant initial t=0 : n(I-) = V1C1 = 10-2*4 10-2 = 4 10-4 mol. n(H2O2)
=V2C2 = 10-2*3
10-2 = 3 10-4 mol. Expression de la vitesse volumique en fonction des concentration en diiode : v = 1/(V1+V2)dx/dt = d[I2]/dt or A= k[I2] soit en fonction de l'absorbance A : v = 1/k dA/dt = 10-2 dA/dt. L'avancement maximal a
été atteint à t = 750 s : la courbe
A=f(t) présente une asymptote horizontale ; celle-ci
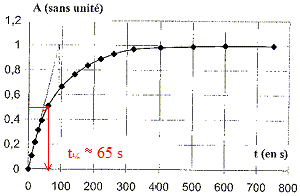
est atteinte à t = 750 s. A t½, l'avancement est égal à la moitié de sa valeur finale ; or l'avancement et l'absorbance sont proportionnels ; d'où par lecture graphique pour A= 0,5 :
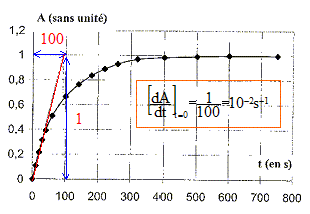
Coefficient directeur de la tangente à l'origine de la courbe A=f(t), à la date t=0 fois 0,01. v = 10-4 mol L-1 s-1. A t = 750 s, la tangente à la courbe étant horizontale, le coefficxient directeur de cette tangente est nul. En conséquence la vitesse est nulle.
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|