- Définissez les sigles ci-dessous :

substance irritante ; substance
nocive ; substance comburante.
- Un étudiant manipule de la lessive de soude et
reçoit des projections dans l'oeil. Que
faîtes-vous ?
lavages à grande
eau.
- De l'acide nitrique concentré a
été renversé sur une paillasse de
TP. Comment nettoyez-vous ?
utiliser une solution
d'hydrogénocarbonate de sodium
NaHCO3.
- Parmi ces métaux, quels
sont ceux considérés comme polluants ?
Hg, Fe, Pb, Cu. mercure Hg
et plomb Pb.
En cas de feu, quel moyen
d'extinction faut-il choisir, dans les cas suivants
:
|
eau
|
extincteur à poudre
|
sable
|
extincteur à neige
carbonique
|
couverture
|
|
feu de papier
|
X
|
|
|
|
|
|
feu électrique
|
|
|
|
X
|
|
|
feu d'hydrocarbure
|
|
X
|
X
|
|
|
|
feu de métal
|
|
X
|
|
|
|
|
feu de vêtement sur une
personne
|
|
|
|
|
X
|
Le tableau suivant présente différents
éléments de verrerie notés de a
à q. Le même tableau liste les noms
de 1 à 20 de différents éléments
de verrerie. Chaque image est répertoriée dans
la liste une seule fois.
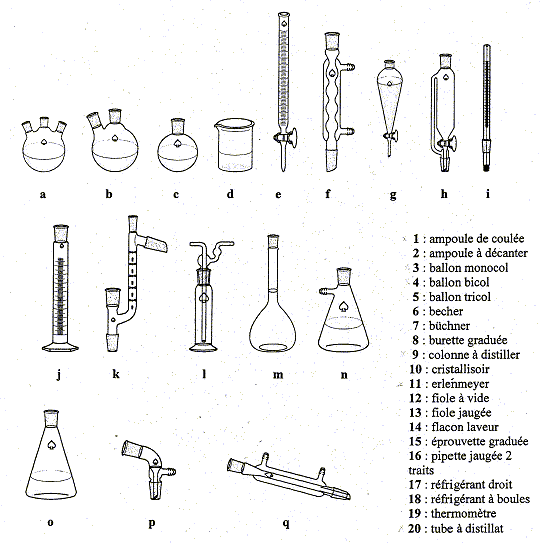
- Affecter à chaque
élément le chiffre qui le
caractérise dans la liste, si cet
élément de verrerie y figure.
ampoule de coulée :
1, h ;
ampoule à
décanter : 2, g ;
ballon monocol : 3,
c ;
ballon bicol : 4,
b ;
ballon tricol : 5,
a ;
becher : 6,
d ;
burette graduée : 8,
e ;
erlenmeyer : 11,
o ;
fiole à vide : 12,
n ;
fiole jaugée : 13,
m ;
flacon laveur : 14,
l ;
réfrigérant
droit : 17, q ;
réfrigérant
à boules : 18, f ;
themomètre : 19,
i ;
- Dans la liste des
éléments a à q,
indiquer, en ne précisant pas les
éléments non disponibles dans la liste,
ceux qui sont nécessaires pour réaliser
:
- un montage de distillation fractionnée :
ballon monocol, colonne
à distiller, thermomètre,
réfrigérant droit,
erlenmeyer.
- un montage de chauffage à reflux :
ballon
monocol,
réfrigérant
à boules.
- un dosage de la soude, contenue dans un produit
ménager concentré par de l'acide
chlorhydrique plus dilué :
burette graduée,
fiole jaugée.
- Après avoir donner le
nombre d'électrons de valence des atomes
6C et 8O, représenter les
formules de Lewis de l'ozone O3, l'anion
carbonate CO32-.

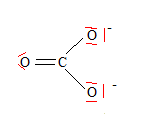
- Le (E)-but-2-ène s'isomérise en
(Z)-but-2-ène sous irradiation ultraviolette.
- De quel type d'isomérie s'agit-il ?
diastéréoisomérie.
- Ecrire la structure topologique de ces deux
composés.
- La constante de vitesse de la réaction vaut k =
3 10-2 s-1. La vitesse initiale de
la réaction vaut v0= 1,2
10-3 mol L-1s-1. Quelle
était la concentration initiale en
(E)-but-2-ène ?
v0 =
k[(E)-but-2-ène]0 ;
[(E)-but-2-ène]0 =
v0/ k = 1,2 10-3 / 3
10-2 = 4 10-2 mol
L-1.
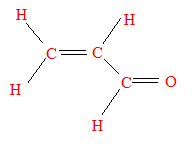
- Le prop-2-ènal P est
susceptible de se dimériser selon une
réaction de Diels-Adler. Fournir la formule
développée de P.
Ce processus suit une loi cinétique du second
ordre en [P] avec une constante de vitesse k =
1,3 10-1 mol L-1 min-1.
On part d'une concentration initiale
[P]0=0,1 mol L-1. Au bout
de comien de temps la concentration en P sera t-elle
divisée par deux ?
½d[P] / dt =
-k[P]2 ; d[P] /
[P]2 = -2kdt ; -d(1/[P] )=
-kdt ; d(1/[P] )=2 kdt
par intégration entre t=0 et t, il vient :
1/[P] -1/[P]0=2kt
1/[P]0=2kt½ ;
t½ = 1/(2k[P]0)=
1/(2*0,13*0,1)= 38 min.
- Parmi les propositions
suivantes identifier le symbole de l'étain : Et,
St,
Sn,
Ti, S.
- Quel composé utilise
t-on ( en plus du dichlore) pour purifier
industriellement l'eau de boisson ?
l'éthanol, le sucre,
l'ozone,
le chlorure de sodium.
- Quel(s) composé(s)
émis par les industries, est (sont) responsable(s)
des pluies acides ?
les nitrates, le
dioxyde de carbone,
l'ozone, les oxydes de
soufre.
- Lorsqu'on dissout des ions
métaliques, comme du sulfate de fer (II) par
exemple, dans l'eau pure, qu'observe t-on ?
le pH ne change
pas, le pH diminue,
le pH augmente.
- Quel est la formule de l'ion
hypochlorite ?
Cl-, ClO3-,
ClO2-,
ClO-.
- Quelle espèce est
caractérisée par le test à la
liqueur de Fehling ?
les cétones, les ions Cu(II),
les
aldehydes, les ions
monohydrogénocarbonates.
- Quelle solution est
utilisée pour caractériser le dioxyde de
carbone dissous ?
le nitrate d'argent, la liqueur de Lucas, le petit lait,
l'eau de
chaux.
- Quel est le produite de
désintégration du carbone
146C sachant que la réaction
s'accompagne de l'émission d'un rayonnement
b-
= 0-1e ?
le carbone 13 136C, le bore 13
135B, l'azote 14
147N, l'oxygène 16
168O.
146C
---> 147N +
0-1e.
- Par qui le fluor a t-il
été découvert ?
en 1774 par Scheele,
en 1886 par
Moissan, en 1898 par
Ramsay, en 1940 par Mackensie.
- Sous la forme polymère,
quel est le nom de la molécule suivante ?
-[-
CH2-CH2-CH2-CH2-CH2-CO-NH-]n-
polyéthylène,
nylon-6,
polystyrène, plexiglass.
- Quel est le nom commun de la
molécule suivante ?
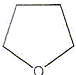
diéthyléther, chloroforme, aniline,
tétrahydrofurane
(THF).
- A quelle grandeur correspond
chaque unité suivante ?
1 L : 10 cm3,
1000
cm3, 100
cm3.
10
dm3
: 1 L,
10
L, 0,1 L.
1 mm
: 10 mm, 103 mm,
10-3
mm.
10 nm : 1 A°,
100
A°, 10
A°.
|






