Etude théorique du titrage par conductimétrie d'une solution S1 d'acide sulfurique de concentration C1 = 0,10 mol /L. La constante de la cellule du conductimètre vaut k = 100 m-1.
Lorsqu'on ajoute une solution titrée S2 de chlorure de baryum, de concentration C2 =0,010 mol /L, dans la solution diluée d'acide sulfurique, on observe la formation d'un précipité blanc.
La formule chimique du précipité est : 
Equation de la réaction de précipitation correspondante :
Le volume de la solution d'acide sulfurique est notée V ( mL) ; le volume de la solution de chlorure de baryum est notée v (mL)
La solution d'acide sulfurique contient des ions
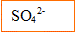
et de ions

Les concentrations initiales valent :
[sulfate]=
mol/L = 0,10*1000 =
mol m-3.
[oxonium]=
*0,10 = 0,20 mol/L = 200 mol m-3.
La solution de chlorure de baryum contient des ions baryum

et des ions

Les concentrations initiales valent :
[baryum] = 0,010 mol/L = 1000*0,010 =
mol m-3.
[chlorure]=2*0,010 = 0,020 mol/L =
mol m-3.
Les ions chlorure sont spectateurs : [chlorure]= n(chlorure) / (V+v) = 0,02 v / (V+v) mol/L = 20 v/(V+v) mol m-3.
Les ions
sont spectateurs :[oxonium]= n(oxonium) /(V+v) = 0,2V / (V+v) mol/L = 200 V/-V+v) mol m-3.
Avant l'équivalence :
Les ions baryum ( en
) réagissent avec les ion sulfate : [baryum]=0
Les ions sulfate sont en
: [sulfate]=n( sulfate)/(V+v) = (0,1V-x)/(V+v) mol/L = 100(0,1V-x)/(V+v) mol m-3.
Expression de la conductivité de la solution :
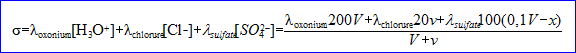
La conductivité
lorsque l'avancement x augmente.
La courbe est une droite si V+v reste à peu près constant ; c'est à dire si V très
à v.
A l'équivalence :
0,1V*Xéq=0 donne Xéq= 0,1V.
Après l'équivalence :
Les ions sulfate sont en
: [sulfate]= 0
Les ions baryum ajoutés sont en
:
[baryum] = (0,01v-Xéq) / (V+v) = (0,01 v- 0,1V) / (V+v)
Expression de la conductivité de la solution :

La conductivité
avec le volume v de solution de chlorure de baryum ajouté.