|
Mécanismes réactionnels D'après le cours " la cinétique du point de vue microscopique" K MORIS - PCSI- chimie. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||
| .
. |
|||||
|
|||||
|
L'ensemble des actes élémentaires qui rend compte des caractéristiques macroscopiques de la réaction chimique globale constitue le mécanisme réactionnel. Il s'agit d'un modèle permettant de retrouver : - la loi de vitesse expérimentale - l'équation stoechiométrique de la réaction globale. La réaction chimique peut être simple ( un seul acte élémentaire comme dans une substitution nucléophile bimoléculaire) ou complexe ( plusieurs actes élémentaires interviennent comme dans une substitution nucléophile monomoléculaire SN1).
L'observation de la réaction à l'échelle microscopique est bien sûr impossible. Par contre certains faits expérimentaux sont observables : - formations de produits secondaires - rôle de la température - le marquage isotopique 18O permet d'identifier la liaison rompue.
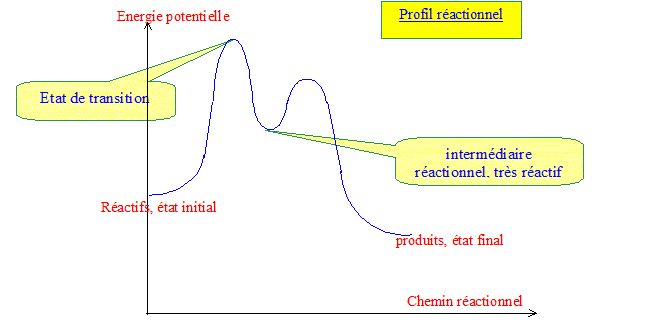
Etat de transition et intermédiaire réactionnel : Un état de transition ou complexe activé ayant une durée de vie de l'ordre de 10-13 s ne peut être ni isolé, ni observé expérimentalement ; sa structure est le fruit d'hypothèses. Par contre un intermédiaire réactionnel ayant une durée de vie assez longue, peut être observé, voir isolé : sa structure peut don être connue.
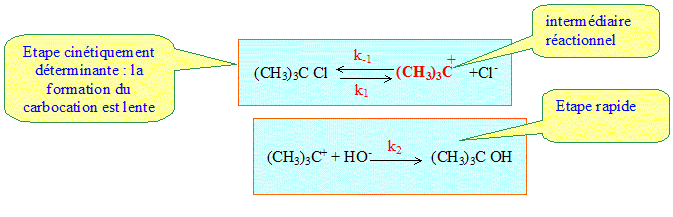
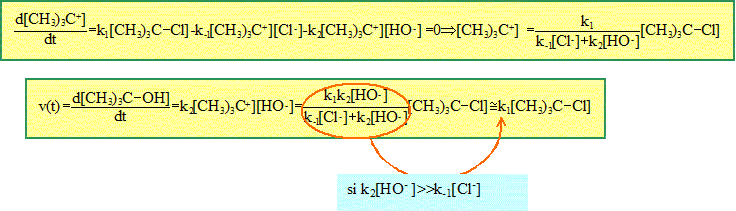
Comment trouver la loi de vitesse ? Etape cinétique déterminante : Soit une série d'actes ou étapes élémentaires successifs : l'un des actes peut être plus difficile à réaliser, ( la constante de vitesse est plus petite que celle des autres étapes, l'énergie potentielle d'activation est la plus grande). Cette étape est dite " cinétiquement déterminante" : elle impose la vitesse des autres étapes et en conséquence la vitesse de la réaction globale. Approximation des états quasi stationnaires ou principe de Bodenstein Soit un intermédiaire réactionnel B, formé lors d'une étape et rapidement consommé dans une seconde étape : B ne peut pas s'accumuler dans le milieu réactionnel ; sa concentration reste faible et pratiquement constante. En conséquence la vitesse de formation de B,
d[B]/dt est proche de
zéro.
Types de mécanismes réactionnels. Par stades. Les actes élémentaires se déroulent à la suite les uns des autres et toujours dans le même ordre. Exemple : substitution SN1. (CH3)3 C-Cl + HO- ---> (CH3)3 C-OH + Cl- L'expérience conduit à la loi de vitesse v = k [(CH3)3 C-Cl]
autre méthode : principe de Bodenstein
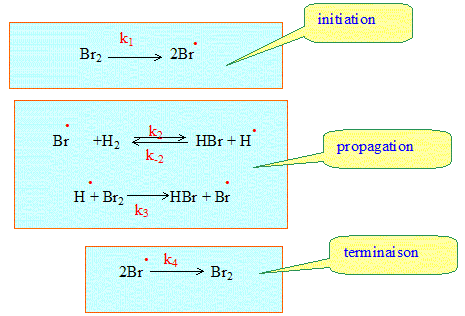
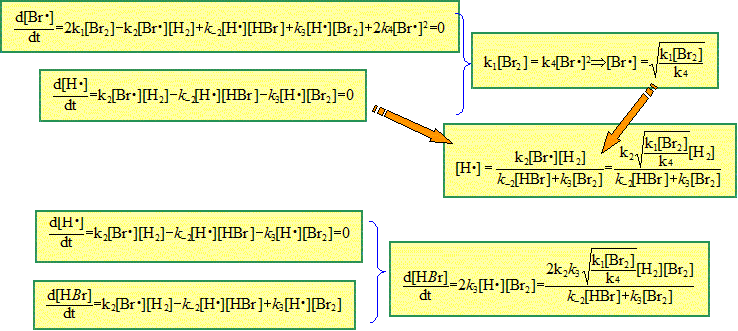
Mécanisme en chaîne. Parmi l'ensemble des actes ou étapes élémentaires, certains se répètent indépendamment des autres. On distingue toujours 3 étapes : - initiation : formation des centres actifs - propagation : formation des produits et régénération des centres actifs - terminaison : disparition des centres actifs. Exemple : H2(g) + Br2(g) --> 2HBr(g). Expression de la vitesse de la réaction : v(t) = ½d[HBr] / dt.
En effectuant la somme de toutes
les étapes, on retrouve bien
H2(g) +
Br2(g) -->
2HBr(g).
|
|||||
|
|
|||||
|
|