|
enseignement, concours caplp externe 2005 : autour des alcools à 3 carbones. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Formule semi-développée et le nom de l’alcane à 3 carbones : propane CH3-CH2-CH3. Formule semi-développée et le nom de l’alcène à 3 carbones : propène CH3-CH=CH2. Formule
semi-développée et le nom de l’alcyne
à 3 carbones : propyne La formule brute d’un alcool à 3 carbones est C3H8O. CH3-CH2-CH2OH prop-1-ène ; alcool primaire CH3-CH
OH-CH3.prop-2-ène ; alcool secondaire.
CH3-CH=CH2 + H2O = CH3-CH OH-CH3. La règle de Markovnikov permet de prévoir
sur quel atome de carbone se fixe l'hydrogène de
l'hydracide ( ou de H2O) : l'atome d'hydrogène se
fixe sur l'atome de carbone le moins substitué (
formation du carbocation le plus stable
)
Equations des réactions de combustions complète et incomplètes de C3H8O : C3H8O + 4,5O2 = 3 CO2 + 4H2O C3H8O + 3O2 = 3 CO + 4H2O C3H8O + 1,5O2 = 3 C + 4H2O Calcul de la masse de dioxyde de carbone obtenue lors de la combustion complète de 12,0 g d’alcool. n(alcool) = m/M = 12,0 / 60,0 = 0,20 mol n(CO2) = 3 n(alcool) =0,60 mol m= n M = 0,60*44 =
26,4
g.
Par action du permanganate de potassium en milieu acide, le propan-1-ol s’oxyde en acide propanoïque CH3-CH2-COOH.
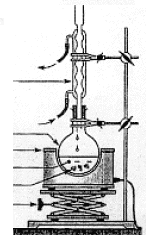
Estérification : Cette réaction
nécessite l’utilisation d’un montage
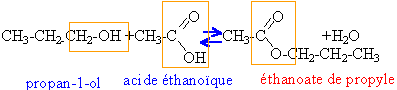
à reflux. Equation de la réaction d’estérification dans le cas de la réaction entre le propan-1-ol et l’acide éthanoïque (ou acide acétique).
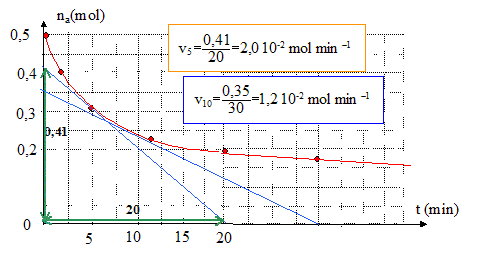
Afin d’accélérer la transformation, on ajoute au mélange réactionnel de l’acide sulfurique et on le porte à température élevée. Le mélange réactionnel initial contient 0,50 mol d’alcool et 0,50 mol d’acide carboxylique. L’équilibre ayant été atteint, le mélange final contient 0,17 mol d’alcool, 0,17 mol d’acide carboxylique, 0,33 mol d’ester et 0,33 mol d’eau. Constante d’équilibre associée à la réaction d’estérification : K= [ester]éq[eau]éq / ([acide]éq [alcool]éq) =(0,33/0,17)2 = 3,8. L’élévation de température ne modifie pas la composition du mélange final : l'estérification est pratiquement athermique. L’évolution de la quantité de matière na en acide carboxylique du mélange précédent a été suivie lors de la transformation. Les valeurs relevées figurent dans le tableau ci-dessous :
Composition approximative du
mélange final, équilibre atteint, dans le cas
d’un mélange
initial constitué de 0,20 mol d’alcool et 0,10
mol d’acide
carboxylique. 2,8 xéq2- 1,14 xéq + 0,076 = 0 ; xéq=0,084 mol |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|