|
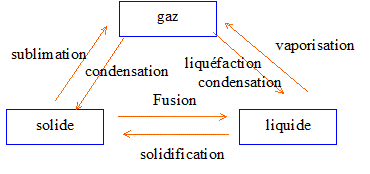
enseignement, concours, caplp interne 2006 : changement d'états de l'eau; chaleur latente de fusion Lf de la glace En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
| .
. |
|||
|
|||
|
Masse du calorimètre et accessoires (y compris le thermomètre) m = 475 g. On verse environ 400 mL d'eau dans le calorimètre. Masse de l'ensemble M = 889 g. D'où la masse d'eau ajoutée m1 = 414 g. Après s’être assuré que l’équilibre thermique (calorimètre – eau) est atteint, on relève la température initiale q1 = 18 °C. Prendre 2 morceaux de glace et les essuyer. On peut admettre que leur température est alors q0 = 0 °C. Introduire les glaçons dans le calorimètre. Fermer. Agiter légèrement en suivant la diminution de température. Lorsque la température se stabilise, vérifier que la glace est fondue. Mesurer la température finale à l'équilibre q2 = 13,5 °C. Peser à nouveau le calorimètre M' = 914 g. En déduire la masse exacte m2 de glace introduite. m2 = 25 g. Données : ceau = 4185 J.kg-1K-1 et m0 = 24,6 g. On considère le système constitué par les deux glaçons. Capacité thermique µ du calorimètre et de ses accessoires : µ =m0 ceau = 24,6 10-3 *4185 = 103 J K-1 Quantités d’énergie thermique échangées à l’équilibre entre le système et les éléments suivants : - le calorimètre de capacité thermique µ : Q1 = µ(q2 -q1 )=103*(13,5-18)= - 463,5 J - l’eau du calorimètre : Q2 = m1 ceau (q2 -q1 )=0,414*4185(13,5-18)= -7796,6 J. Quantité d’énergie thermique Q3, absorbée par le système lors de la fusion : Q3 = m2 Lf = 0,025 Lf Quantité d’énergie thermique Q4 absorbée à l’équilibre par l’eau de fusion de la glace : Q4 = m2ceau (q2 -q0 ) =0,025*4185*13,5 = 1412,5 J. Relation qui existe à l’équilibre entre ces quantités d’énergie thermique : ( système adiabatique) |énergie cédée par les corps chauds |= énergie gagnée par les corps froids |Q1 +Q2 | =Q3 +Q4. 463,5+7796,6 = 1412,5 + 0,025 Lf. Chaleur de fusion Lf de la glace : Lf = 273 900 J kg-1. Les tables donnent pour la chaleur latente Lf de fusion de la glace une valeur de l’ordre de 330 kJ.kg-1. Principales causes d’erreurs sur le résultat dans le cas d’une telle manipulation : Echange d'énergie entre le calorimètre et l'air extérieur ; masse du glaçon peu précise ; valeur en eau du calorimètre incertaine.
On a placé l’eau du calorimètre (M = 439 g) dans une bouilloire électrique et on a élevé sa température jusqu’au début de l’ébullition ; cette quantité d’eau constitue le système étudié. On continue à chauffer jusqu’à évaporer la totalité de l’eau, sous la pression atmosphérique normale considérée constante ; on s’intéresse à ce qui se produit uniquement dans la période de vaporisation de l’eau. Echanges de chaleur et de travail entre le système constitué par l’eau de la bouilloire et le milieu extérieur durant cette période ; les calculer. Données : la chaleur de vaporisation de l’eau est Lv = 2,26.106 J.kg-1 à 100°C ; on supposera que la vapeur d’eau est un gaz parfait ; R = 8,314 J.kg-1.mol-1 ; on ne tiendra pas compte de la chaleur absorbée par la bouilloire. Energie reçue par l'eau au cours de la vaporisation : Q= M Lv = 0,439*2,26.106 =9,92 105 J. Travail mis en jeu ( expansion de la vapeur) à pression constante : W= - P(Vfinal-Vinitial) avec Vinitial = 0,439 L = 4,39 10-4 m3. PVfinal= n RT ; Vfinal=nRT/P P= 1,013 105 Pa ; T= 100+273 = 373 K ; n = m/Meau = 439/18 = 24,39 mol Vfinal= 24,39*8,314*300/1,013 105 =0,7446 m3. W= - 1,013 105 (0,7446- 4,39 10-4 )= - 7,56 104 J.
DU = W+Q = -7,56 104 + 9,92 105 = 9,16 105 J. Variation d’enthalpie DH pendant l’évaporation de l’eau : H= U+PV ; DH = DU+ D(PV)= DU+ P DV + VDP Or la pression est constante donc DP =0. DH = DU+P DV or DU =W+Q et W= -PDV d'où DH =Q ( ce qui est caractéristique d'une transformation isobare) |
|||
|
|
|||
|
|